7.3: Fázisváltozások
tanulási célok
- határozza meg a fázisváltozással járó hőt.
Az anyag számos különböző állapot egyikében létezhet, beleértve a gázt, a folyadékot vagy a szilárd állapotot. Az anyag molekuláiban az energia mennyisége határozza meg az anyag állapotát.
- a gáz olyan anyagállapot, amelyben az atomoknak vagy molekuláknak elegendő energiájuk van a szabad mozgáshoz. A molekulák csak akkor érintkeznek egymással, ha véletlenszerűen ütköznek.
- a folyadék olyan anyagállapot, amelyben az atomok vagy molekulák folyamatosan érintkeznek, de elegendő energiájuk van ahhoz, hogy egymáshoz képest változó pozíciókat tartsanak.
- a szilárd anyag olyan állapot, amelyben az atomoknak vagy molekuláknak nincs elegendő energiájuk a mozgáshoz. Folyamatosan érintkeznek egymással, egymáshoz képest rögzített helyzetben vannak.
az állapotváltozások a következők:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- ha egy anyaghoz hőt adnak, például olvadás, párologtatás és szublimáció során, az eljárás endotermikus. Ebben az esetben a hő növeli a molekulák sebességét, ami gyorsabban mozog (példák: szilárd vagy folyékony; folyadék gáz; szilárd vagy gáz).
- ha hőt távolítanak el egy anyagtól, például fagyasztás és kondenzáció esetén, akkor a folyamat exoterm. Ebben az esetben a hő csökkenti a molekulák sebességét, ami lassabban mozog (példák: folyadék szilárd; gáz folyadék). Ezek a változások hőt bocsátanak ki a környezetbe.
- az A hőmennyiség, ahhoz szükséges, hogy a minta a szilárd, folyékony lenne, ugyanezt fordított a folyadék szilárd. Az egyetlen különbség a hőátadás iránya.
Example \(\PageIndex{1}\)
az alábbi folyamatok mindegyikét endoterm vagy exoterm címkével látja el.
- vízforralás
- jégképződés egy tóban
oldat
- endotermikus – egy serpenyőt kell a tűzhelyre tenni, és melegíteni kell ahhoz, hogy a víz forrni kezdjen. Mivel hőt/energiát ad hozzá, a reakció endoterm.
- exoterm-gondolj inkább a fagyasztóban kialakuló jégre. Vizet helyez a fagyasztóba, amely hőt vesz ki a vízből, hogy lefagyjon. Mivel a hőt kivonják a vízből, exoterm. A hőség távozik.
Exercise \(\PageIndex{1}\)
az alábbi folyamatok mindegyikét endotermikus vagy exotermikusként tüntesse fel.
- vízgőz kondenzáció
- aranyolvadás
válasz
a. exoterm
b. endoterm
a fázisváltozás olyan fizikai folyamat, amelyben az anyag egyik fázisból a másikba megy. Általában a változás akkor következik be, amikor hőt ad hozzá vagy távolít el egy adott hőmérsékleten, amelyet az anyag olvadáspontjának vagy forráspontjának neveznek. Az olvadáspont az a hőmérséklet, amelyen az anyag szilárd anyagból folyadékba (vagy folyadékból szilárd anyagba) kerül. A forráspont az a hőmérséklet, amelyen az anyag folyadékból gázba (vagy gázból folyadékba) kerül. A fázisváltozás jellege a hőátadás irányától függ. Az anyagba jutó hő egy szilárd anyagról folyadékra vagy folyadékra gázra változtatja. Az anyagból származó hő eltávolítása a gázt folyadékra vagy folyadékra szilárd anyaggá változtatja.
két kulcsfontosságú pontot érdemes hangsúlyozni. Először is, egy anyag olvadáspontjában vagy forráspontjában két fázis létezhet egyszerre. Vegyük például a vizet (H2O). A Celsius-skálán a H2O olvadáspontja 0°C, forráspontja 100°C. 0°C-on a H2O szilárd és folyékony fázisai együtt élhetnek. Ha azonban hőt adunk hozzá, a szilárd H2o egy része megolvad és folyékony H2O-vá alakul. Ha a hőt eltávolítják, az ellenkezője történik: a H2O folyadék egy része szilárd H2O-ra változik. hasonló folyamat fordulhat elő 100°C-on:a hő hozzáadása növeli a H2O gáz halmazállapotú mennyiségét, míg a hő eltávolítása növeli a H2O folyadék mennyiségét (ábra \(\PageIndex{1}\)).
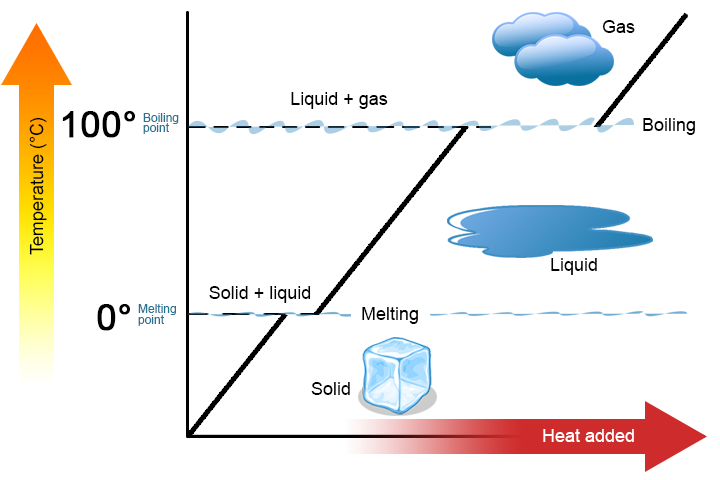
a víz jó anyag, amelyet példaként lehet használni, mert sokan már ismerik. Más anyagok olvadáspontjai és forráspontjai is vannak.
második, amint azt a \(\PageIndex{1}\) ábra mutatja, az anyag hőmérséklete nem változik, mivel az anyag egyik fázisból a másikba megy. Más szavakkal, a fázisváltozások izotermikusak (az izotermikus jelentése “állandó hőmérséklet”). Ismét vegyük példaként a H2O-t. Szilárd víz (jég) létezhet 0°C-on Ha hőt adunk a jég 0°C-on, néhány szilárd változások fázisban, hogy a folyadék, ami szintén 0°C-on ne feledje, a szilárd és folyékony fázisok H2O együtt élhetnek 0°C-on csak miután az összes szilárd anyag olvadt folyadékba nem a hő hozzáadása megváltoztatja a hőmérséklet az anyag.
Az anyag minden fázisváltozásához jellemző mennyiségű hő szükséges az anyag grammonként (vagy mólonként) történő fázisváltozás végrehajtásához. A fúzió hője (ΔHfus) az olvadáspontban bekövetkező fázisváltozáshoz szükséges grammonkénti (vagy mólonkénti) hőmennyiség. A párologtatás hője (ΔHvap) az a hőmennyiség grammonként (vagy mólonként), amely a forráspontban bekövetkező fázisváltozáshoz szükséges. Ha tudod a száma gramm vagy mol anyag, akkor használja a ΔHfus vagy a ΔHvap, hogy meghatározzák a teljes hő áthelyezték az olvadó vagy megszilárdulása használja ezeket a kifejezéseket:
\
amennyiben \(n\) az a szám, mol, valamint a \(ΔH_{hívnunk rufust}\) van kifejezve energia/tégla, vagy
\
amennyiben \(m\) a tömeg a gramm, s \(ΔH_{hívnunk rufust}\) van kifejezve energia/gramm.
forráshoz vagy kondenzációhoz használja ezeket a kifejezéseket:
\
ahol \ (n\) az anyajegyek száma) és \(ΔH_{vap}\) energiában/anyajegyben vagy
\
ahol \(m\) a tömeg grammban és \(ΔH_{vap}\) energiában/grammban van kifejezve.
ne feledje, hogy a fázisváltozás a hőátadás irányától függ. Ha a hő átterjed, a szilárd anyagok folyadékokká válnak, a folyadékok pedig szilárd anyagokká válnak az olvadáspontokban, illetve a forráspontokban. Ha a hő kiáramlik, a folyadékok megszilárdulnak, a gázok pedig folyadékokká kondenzálódnak. Ezeken a pontokon a hőmérséklet nem változik, amint azt a fenti egyenletek tükrözik.
Table \ (\PageIndex{1}\) felsorolja a fúzió és párologtatás melegét néhány gyakori anyag esetében. Jegyezze fel ezeket a mennyiségeket; amikor ezeket az értékeket használja a problémamegoldás során, győződjön meg róla, hogy a számítás többi változóját egységekben fejezik ki, amelyek összhangban vannak az adott melegítésben lévő egységekkel vagy a fúzió és párolgás melegítésével.
szublimáció
van egy fázisváltozás is, amikor egy szilárd anyag közvetlenül a gázhoz megy:
\
ezt a fázisváltozást szublimációnak nevezik. Minden anyagnak jellegzetes szublimációs hője van ezzel a folyamattal. Például a H2O szublimációs hője (ΔHsub) 620 cal/g.
többféle módon találkozunk szublimációval. Lehet, hogy már ismeri a szárazjeget, amely egyszerűen szilárd szén-dioxid (CO2). -78, 5°C-on (-109°F) a szilárd szén-dioxid szublimálódik, közvetlenül a szilárd fázisról a gázfázisra váltva:
\
a szilárd szén-dioxidot szárazjégnek nevezik, mert nem halad át a folyékony fázison. Ehelyett közvetlenül a gázfázishoz vezet. (A szén-dioxid folyadékként létezhet, de csak nagy nyomás alatt.) A szárazjégnek számos gyakorlati felhasználása van, beleértve az orvosi minták hosszú távú megőrzését.
még 0°C alatti hőmérsékleten is, a szilárd H2O lassan fenséges. Például egy vékony hóréteg vagy fagy a földön lassan eltűnik, amikor a szilárd H2O szublimál, annak ellenére, hogy a külső hőmérséklet a víz fagypont alatt lehet. Hasonlóképpen, a fagyasztóban lévő jégkockák idővel kisebbek lehetnek. Bár fagyott, a szilárd víz lassan szublimálódik, újrapozitálja a fagyasztó hidegebb hűtőelemeit, ami időszakos leolvasztást igényel (a fagymentes fagyasztók minimalizálják ezt a redepozíciót). A fagyasztó hőmérsékletének csökkentése csökkenti a leolvasztás szükségességét.
hasonló körülmények között a víz a fagyasztott élelmiszerekből (például húsokból vagy zöldségekből) is fenséges lesz, ami vonzó, foltos megjelenést kölcsönöz nekik, úgynevezett fagyasztó égésnek. Ez nem igazán egy “égés”, az étel nem feltétlenül ment rossz, bár úgy néz ki, étvágytalan. A fagyasztó égetése minimalizálható a fagyasztó hőmérsékletének csökkentésével, valamint az élelmiszerek szoros csomagolásával, így a víznek nincs helye a fenékbe.
Concept Review experiences
- magyarázza el, mi történik, ha a hő egy anyagba vagy annak olvadáspontjába vagy forráspontjába áramlik.
- hogyan viszonyul a fázisváltozáshoz szükséges hőmennyiség az anyag tömegéhez?
- mi a hőátadás iránya forrásban lévő vízben?
- mi a hőátadás iránya a fagyos vízben?
- mi a hőátadás iránya a verejtékezésben?
válaszok
1. Az energia a fázis megváltoztatásába kerül, nem a hőmérsékletbe.
2. A hőmennyiség állandó gramm anyagonként.
3. Forr. Hő kerül hozzáadásra a vízhez, hogy a folyékony állapotból a gáz állapotba kerüljön.
4. Megfagyok. A hő kilép a rendszerből, hogy folyadékról szilárdra menjen. Egy másik módja annak, hogy megnézzük, az olvadás ellentétes folyamata. Energiát fogyasztanak (endoterm) a jég olvadásához (szilárd vagy folyékony), így az ellenkező folyamatnak (folyadék vagy szilárd) exotermnek kell lennie.
5. Izzadok. A hőt a bőr nedvességének elpárologtatására fogyasztják, ami csökkenti a hőmérsékletet.
Key Takeaway
- minden fázisváltozáshoz energia változás társul.
-
mennyi energiára van szükség ahhoz, hogy 43,8 g Au olvadáspontja 1,064°C legyen?
-
mennyi energiát adnak ki, amikor 563.8 g NaCl megszilárdul a 801°C-os fagyási pontján?
-
milyen tömegű jég olvadhat 558 cal energiával?
-
mennyi etanol (C2H5OH) grammban lefagyhat a fagyasztási pontján, ha 1225 cal hőt távolítanak el?
-
mi az anyag elpárologtatásának hője, ha 10,776 cal szükséges az 5,05 g elpárologtatásához? Fejezze ki a végső választ Joules grammonként.
-
Ha 1650 cal hőre van szükség egy olyan minta elpárologtatásához, amelynek 137 cal/g párolgási hője van, mi a minta tömege?
-
mi a víz fúziójának hője kalóriánként mólonként?
-
mi a benzol (C6H6) párologtatásának hője a mólonkénti kalóriákban?
-
mi az arany párologtatásának hője kalóriánként mólonként?
-
mi a vas fúziójának hője kalóriánként mólonként?
válaszok
-
670 cal
3. 6, 98 g
4. 27.10 g
-
8,930 J/g
-
1,440 cal/mol
9. 80,600 cal / mol
10. 3,530 cal/mol
Leave a Reply