7.3: Phasenwechsel
Lernziele
- Bestimmen Sie die mit einem Phasenwechsel verbundene Wärme.
Materie kann in einem von mehreren verschiedenen Zuständen existieren, einschließlich eines gasförmigen, flüssigen oder festen Zustands. Die Energiemenge in Molekülen der Materie bestimmt den Zustand der Materie.
- Ein Gas ist ein Materiezustand, in dem Atome oder Moleküle genügend Energie haben, um sich frei zu bewegen. Die Moleküle kommen nur dann miteinander in Kontakt, wenn sie zufällig kollidieren. Eine Flüssigkeit ist ein Materiezustand, in dem Atome oder Moleküle ständig in Kontakt sind, aber genug Energie haben, um ihre Position relativ zueinander zu ändern.
- Ein Festkörper ist ein Materiezustand, in dem Atome oder Moleküle nicht genug Energie haben, um sich zu bewegen. Sie sind ständig in Kontakt und in festen Positionen relativ zueinander.
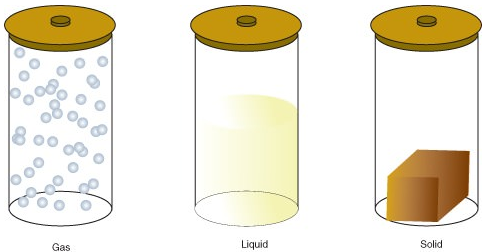
Im Folgenden sind die Zustandsänderungen:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- Wenn einer Substanz Wärme zugesetzt wird, z. B. beim Schmelzen, Verdampfen und Sublimieren, ist der Prozess endotherm. In diesem Fall erhöht Wärme die Geschwindigkeit der Moleküle, wodurch sie sich schneller bewegen (Beispiele: fest zu flüssig; flüssig zu Gas; fest zu Gas).
- Wenn einem Stoff Wärme entzogen wird, z. B. beim Gefrieren und Kondensieren, ist der Prozess exotherm. In diesem Fall verringert Wärme die Geschwindigkeit der Moleküle, wodurch sie sich langsamer bewegen (Beispiele: Flüssigkeit zu Feststoff; Gas zu Flüssigkeit). Diese Veränderungen geben Wärme an die Umgebung ab.
- Die Wärmemenge, die benötigt wird, um eine Probe von fest zu flüssig zu wechseln, wäre die gleiche, um von flüssig zu fest umzukehren. Der einzige Unterschied ist die Richtung der Wärmeübertragung.
Beispiel \(\pageIndex{1}\)
Kennzeichnen Sie jeden der folgenden Prozesse als endotherm oder exotherm.
- kochendes Wasser
- Eisbildung auf einem Teich
Lösung
- endotherm – Sie müssen eine Pfanne mit Wasser auf den Herd stellen und erhitzen, damit das Wasser kocht. Da Sie Wärme / Energie hinzufügen, ist die Reaktion endotherm.
- exotherm – Denken Sie stattdessen an Eisbildung in Ihrem Gefrierschrank. Sie geben Wasser in den Gefrierschrank, der dem Wasser Wärme entzieht, damit es einfriert. Da dem Wasser Wärme entzogen wird, ist es exotherm. Hitze geht.
Übung \(\pageIndex{1}\)
Kennzeichnen Sie jeden der folgenden Prozesse als endotherm oder exotherm.
- Wasserdampfkondensation
- Goldschmelzen
Antwort
a. exotherm
b. endotherm
Ein Phasenwechsel ist ein physikalischer Prozess, bei dem eine Substanz von einer Phase in eine andere übergeht. Normalerweise tritt die Änderung auf, wenn Wärme bei einer bestimmten Temperatur hinzugefügt oder entfernt wird, die als Schmelzpunkt oder Siedepunkt der Substanz bekannt ist. Der Schmelzpunkt ist die Temperatur, bei der die Substanz von einem Feststoff zu einer Flüssigkeit (oder von einer Flüssigkeit zu einem Feststoff) übergeht. Der Siedepunkt ist die Temperatur, bei der eine Substanz von einer Flüssigkeit zu einem Gas (oder von einem Gas zu einer Flüssigkeit) übergeht. Die Art der Phasenänderung hängt von der Richtung der Wärmeübertragung ab. Wärme, die in eine Substanz eintritt, verändert sie von einem Feststoff zu einer Flüssigkeit oder einer Flüssigkeit zu einem Gas. Durch das Entfernen von Wärme aus einer Substanz wird ein Gas in eine Flüssigkeit oder eine Flüssigkeit in einen Feststoff umgewandelt.
Zwei wichtige Punkte sind hervorzuheben. Erstens können am Schmelzpunkt oder Siedepunkt einer Substanz zwei Phasen gleichzeitig existieren. Nehmen Sie Wasser (H2O) als Beispiel. Auf der Celsius-Skala hat H2O einen Schmelzpunkt von 0 ° C und einen Siedepunkt von 100 ° C. Bei 0 ° C können sowohl die feste als auch die flüssige Phase von H2O koexistieren. Wenn jedoch Wärme hinzugefügt wird, schmilzt ein Teil des festen H2O und wird zu flüssigem H2O. Wenn Wärme abgeführt wird, geschieht das Gegenteil: Ein Teil des flüssigen H2O wird zu festem H2O. Ein ähnlicher Prozess kann bei 100 ° C auftreten: Die Zugabe von Wärme erhöht die Menge an gasförmigem H2O, während die Abfuhr von Wärme die Menge an flüssigem H2O erhöht (Abbildung \(\pageIndex{1}\)).
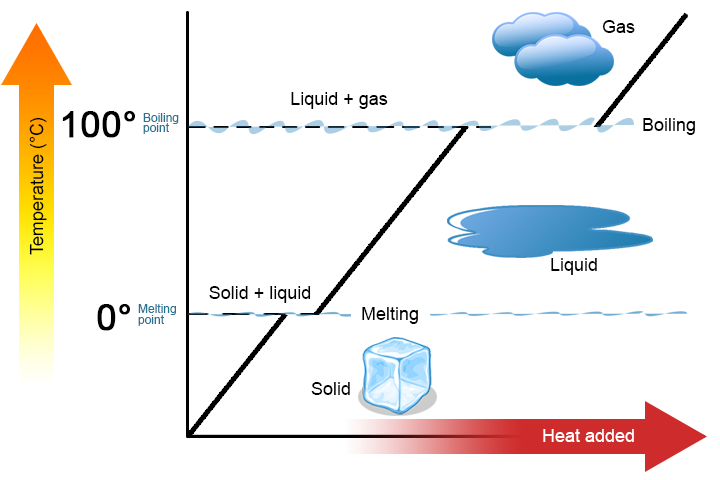
Wasser ist eine gute Substanz als Beispiel, da viele Menschen bereits damit vertraut sind. Andere Substanzen haben auch Schmelzpunkte und Siedepunkte.
Zweitens ändert sich, wie in Abbildung \(\pageIndex{1}\) gezeigt, die Temperatur eines Stoffes nicht, wenn der Stoff von einer Phase in eine andere übergeht. Mit anderen Worten, Phasenänderungen sind isotherm (isotherm bedeutet „konstante Temperatur“). Betrachten Sie H2O als Beispiel. Festes Wasser (Eis) kann bei 0 ° C existieren. Wenn dem Eis bei 0 ° C Wärme zugesetzt wird, ändert sich ein Teil des Feststoffs in eine Flüssigkeit, die ebenfalls bei 0 ° C liegt. Denken Sie daran, dass die feste und die flüssige Phase von H2O bei 0 ° C koexistieren können.Für jede Phasenänderung einer Substanz gibt es eine charakteristische Wärmemenge, die benötigt wird, um die Phasenänderung pro Gramm (oder pro Mol) Material durchzuführen. Die Fusionswärme (ΔHfus) ist die Wärmemenge pro Gramm (oder pro Mol), die für eine Phasenänderung erforderlich ist, die am Schmelzpunkt auftritt. Die Verdampfungswärme (ΔHvap) ist die Wärmemenge pro Gramm (oder pro Mol), die für eine Phasenänderung erforderlich ist, die am Siedepunkt auftritt. Wenn Sie die Gesamtzahl der Gramm oder Mol Material kennen, können Sie ΔHfus oder ΔHvap verwenden, um die Gesamtwärme zu bestimmen, die zum Schmelzen oder Erstarren übertragen wird, indem Sie diese Ausdrücke verwenden:
\
wobei \(n\) die Anzahl der Mol ist und \(ΔH_{fus}\) in Energie / Mol ausgedrückt wird oder
\
wobei \(m\) die Masse in Gramm ist und \(ΔH_{fus} \) wird in Energie/Gramm ausgedrückt.
Für das Kochen oder Kondensation, verwenden Sie diese Ausdrücke:
\
wobei \(n\) die Anzahl der Mol ist) und \(ΔH_{vap}\) in Energie/Mol ausgedrückt wird oder
\
wobei \(m\) die Masse in Gramm ist und \(ΔH_{vap}\) in Energie/Gramm ausgedrückt wird.
Denken Sie daran, dass eine Phasenänderung von der Richtung der Wärmeübertragung abhängt. Wenn Wärmeübertragungen in, Feststoffe werden Flüssigkeiten, und Flüssigkeiten werden Feststoffe an den Schmelz- und Siedepunkten, beziehungsweise. Wenn Wärme austritt, erstarren Flüssigkeiten und Gase kondensieren zu Flüssigkeiten. An diesen Punkten gibt es keine Temperaturänderungen, wie sie sich in den obigen Gleichungen widerspiegeln.
Tabelle \(\pageIndex{1}\) listet die Schmelz- und Verdampfungswärme einiger gängiger Substanzen auf. Beachten Sie die Einheiten für diese Größen; Wenn Sie diese Werte bei der Problemlösung verwenden, stellen Sie sicher, dass die anderen Variablen in Ihrer Berechnung in Einheiten ausgedrückt werden, die mit den Einheiten in den spezifischen Heizen oder den Heizen der Fusion und Verdampfung übereinstimmen.
Sublimation
Es gibt auch eine Phasenänderung, bei der ein Feststoff direkt in ein Gas übergeht:
\
Diese Phasenänderung wird Sublimation genannt. Jede Substanz hat eine charakteristische Sublimationswärme, die mit diesem Prozess verbunden ist. Zum Beispiel beträgt die Sublimationswärme (ΔHsub) von H2O 620 cal/ g.
Wir begegnen Sublimation auf verschiedene Arten. Möglicherweise kennen Sie bereits Trockeneis, bei dem es sich einfach um festes Kohlendioxid (CO2) handelt. Bei -78,5 ° C (-109 ° F) sublimiert festes Kohlendioxid und wechselt direkt von der festen Phase in die Gasphase:
\
Festes Kohlendioxid wird als Trockeneis bezeichnet, da es die flüssige Phase nicht passiert. Stattdessen geht es direkt in die Gasphase. (Kohlendioxid kann als Flüssigkeit existieren, aber nur unter hohem Druck. Trockeneis hat viele praktische Anwendungen, einschließlich der Langzeitkonservierung von medizinischen Proben.
Selbst bei Temperaturen unter 0°C sublimiert festes H2O langsam. Zum Beispiel kann eine dünne Schicht Schnee oder Frost auf dem Boden langsam verschwinden, wenn das feste H2O sublimiert, obwohl die Außentemperatur unter dem Gefrierpunkt von Wasser liegen kann. Ebenso können Eiswürfel in einem Gefrierschrank mit der Zeit kleiner werden. Obwohl gefroren, sublimiert das feste Wasser langsam und setzt sich auf den kälteren Kühlelementen des Gefrierschranks wieder ab, was ein periodisches Auftauen erfordert (frostfreie Gefriergeräte minimieren diese Wiederablagerung). Wenn Sie die Temperatur in einem Gefrierschrank senken, müssen Sie nicht so oft auftauen.
Unter ähnlichen Umständen sublimiert Wasser auch aus Tiefkühlkost (z. B. Fleisch oder Gemüse) und verleiht ihnen ein unattraktives, fleckiges Aussehen, das als Gefrierbrand bezeichnet wird. Es ist nicht wirklich ein „Brennen“, und das Essen ist nicht unbedingt schlecht geworden, obwohl es unappetitlich aussieht. Gefrierbrand kann minimiert werden, indem die Temperatur eines Gefrierschranks gesenkt und Lebensmittel fest eingewickelt werden, damit kein Wasser eindringen kann.
Concept Review Übungen
- Erklären, was passiert, wenn Wärme in oder aus einer Substanz an ihrem Schmelzpunkt oder Siedepunkt fließt.
- Wie hängt die für einen Phasenwechsel benötigte Wärmemenge mit der Masse des Stoffes zusammen?
- Wie ist die Richtung der Wärmeübertragung in kochendem Wasser?
- Wie ist die Richtung der Wärmeübertragung in gefrierendem Wasser?
- Wie ist die Richtung der Wärmeübertragung beim Schwitzen?
Antworten
1. Die Energie geht in die Änderung der Phase, nicht die Temperatur.
2. Die Wärmemenge ist eine Konstante pro Gramm Substanz.
3. Kochendem. Dem Wasser wird Wärme zugesetzt, um es vom flüssigen in den gasförmigen Zustand zu bringen.
4. Einfrieren. Wärme tritt aus dem System aus, um von flüssig zu fest zu gelangen. Eine andere Möglichkeit, es zu betrachten, besteht darin, den entgegengesetzten Schmelzprozess zu betrachten. Energie wird verbraucht (endotherm), um Eis zu schmelzen (fest zu flüssig), so dass der entgegengesetzte Prozess (flüssig zu fest) exotherm sein muss.
5. Schwitzen. Wärme wird verbraucht, um die Feuchtigkeit auf Ihrer Haut zu verdampfen, was Ihre Temperatur senkt.
Key Takeaway
- Mit jeder Phasenänderung ist eine Energieänderung verbunden.
-
Wie viel Energie wird benötigt, um 43,8 g Au bei einem Schmelzpunkt von 1.064 °C zu schmelzen?
-
Wie viel Energie abgegeben wird, wenn 563.8 g NaCl erstarrt bei seinem Gefrierpunkt von 801 °C?
-
Welche Eismasse kann mit 558 cal Energie geschmolzen werden?
-
Wie viel Ethanol (C2H5OH) in Gramm kann bei seinem Gefrierpunkt einfrieren, wenn 1.225 cal Wärme entfernt werden?
-
Was ist die Verdampfungswärme einer Substanz, wenn 10.776 cal benötigt werden, um 5,05 g zu verdampfen? Drücken Sie Ihre endgültige Antwort in Joule pro Gramm aus.
-
Wenn 1.650 cal Wärme benötigt werden, um eine Probe mit einer Verdampfungswärme von 137 cal / g zu verdampfen, wie groß ist die Masse der Probe?
-
Was ist die Schmelzwärme von Wasser in Kalorien pro Mol?
-
Was ist die Verdampfungswärme von Benzol (C6H6) in Kalorien pro Mol?
-
Was ist die Verdampfungswärme von Gold in Kalorien pro Mol?
-
Was ist die Schmelzwärme von Eisen in Kalorien pro Mol?
Wie viel Energie wird benötigt, um 43,8 g Au bei einem Schmelzpunkt von 1.064 °C zu schmelzen?
Wie viel Energie abgegeben wird, wenn 563.8 g NaCl erstarrt bei seinem Gefrierpunkt von 801 °C?
Welche Eismasse kann mit 558 cal Energie geschmolzen werden?
Wie viel Ethanol (C2H5OH) in Gramm kann bei seinem Gefrierpunkt einfrieren, wenn 1.225 cal Wärme entfernt werden?
Was ist die Verdampfungswärme einer Substanz, wenn 10.776 cal benötigt werden, um 5,05 g zu verdampfen? Drücken Sie Ihre endgültige Antwort in Joule pro Gramm aus.
Wenn 1.650 cal Wärme benötigt werden, um eine Probe mit einer Verdampfungswärme von 137 cal / g zu verdampfen, wie groß ist die Masse der Probe?
Was ist die Schmelzwärme von Wasser in Kalorien pro Mol?
Was ist die Verdampfungswärme von Benzol (C6H6) in Kalorien pro Mol?
Was ist die Verdampfungswärme von Gold in Kalorien pro Mol?
Was ist die Schmelzwärme von Eisen in Kalorien pro Mol?
Antworten
-
670 cal
3. 6,98 g
4. 27,10 g
-
8.930 J/g
-
1.440 cal/mol
9. 80.600 cal/mol
10. 3.530 cal/mol
Leave a Reply