7.3: fázové změny
cíle učení
- Určete teplo spojené se změnou fáze.
hmota může existovat v jednom z několika různých stavů, včetně plynu, kapaliny nebo pevného stavu. Množství energie v molekulách hmoty určuje stav hmoty.
- plyn je stav hmoty, ve kterém atomy nebo molekuly mají dostatek energie k volnému pohybu. Molekuly přicházejí do vzájemného kontaktu pouze tehdy, když se náhodně srazí.
- kapalina je stav hmoty, ve kterém jsou atomy nebo molekuly neustále v kontaktu, ale mají dostatek energie, aby si navzájem měnily pozice.
- pevná látka je stav hmoty, ve kterém atomy nebo molekuly nemají dostatek energie k pohybu. Jsou neustále v kontaktu a v pevných polohách vůči sobě navzájem.
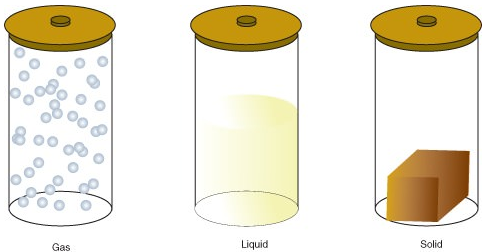
níže jsou uvedeny změny stavu:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- Pokud je teplo dodané látce, jako při tání, vypařování, sublimace, proces je endotermické. V tomto případě teplo zvyšuje rychlost molekul, což způsobuje, že se pohybují rychleji (příklady: pevná látka na kapalinu; kapalina na plyn; pevná látka na plyn).
- pokud se z látky odvádí teplo, například při zmrazování a kondenzaci, je proces exotermní. V tomto případě teplo snižuje rychlost molekul, což způsobuje, že se pohybují pomaleji (příklady: kapalina na pevnou látku; plyn na kapalinu). Tyto změny uvolňují teplo do okolí.
- množství tepla potřebné ke změně vzorku z pevné látky na kapalinu by být stejné zvrátit z kapalného na pevné. Jediným rozdílem je směr přenosu tepla.
příklad \(\PageIndex{1}\)
označte každý z následujících procesů jako endotermický nebo exotermický.
- vroucí vody
- led se tvoří na hladině
Řešení
- endotermické – musíte dát hrnec s vodou na sporáku a dát mu teplo ve snaze dostat vodu do varu. Protože přidáváte teplo / energii, reakce je endotermická.
- exotermický-myslete na led tvořící v mrazáku místo. Do mrazničky vložíte vodu, která z vody vytahuje teplo, aby zmrzla. Protože se z vody vytahuje teplo, je exotermní. Teplo odchází.
Cvičení \(\PageIndex{1}\)
označte každou z následujících procesy jako endotermické nebo exotermické.
- kondenzace vodní páry
- tavení zlata
odpověď
a. exotermická
b. endotermická
fázová změna je fyzický proces, při kterém látka přechází z jedné fáze do druhé. Obvykle ke změně dochází při přidávání nebo odstraňování tepla při určité teplotě, známé jako bod tání nebo bod varu látky. Teplota tání je teplota, při které látka přechází z pevné látky na kapalinu(nebo z kapaliny na pevnou látku). Bod varu je teplota, při které látka přechází z kapaliny na plyn(nebo z plynu na kapalinu). Povaha fázové změny závisí na směru přenosu tepla. Teplo přecházející do látky jej mění z pevné látky na kapalinu nebo kapalinu na plyn. Odvádění tepla z látky mění plyn na kapalinu nebo kapalinu na pevnou látku.
stojí za to zdůraznit dva klíčové body. Za prvé, při bodu tání nebo bodu varu látky mohou existovat dvě fáze současně. Jako příklad vezměte vodu (H2O). Na stupnici Celsia má H2O teplotu tání 0°C a teplotu varu 100°C. při 0°C mohou koexistovat jak pevná, tak kapalná fáze H2O. Pokud se však přidá teplo, část pevné látky H2O se roztaví a změní se na kapalnou H2O. Pokud teplo se odstraní, stane se pravý opak: některé z kapalné H2O promění v solidní H2O. Podobný proces může nastat při 100°C: přidání teplo zvyšuje množství plynných H2O, při odstraňování tepla se zvyšuje množství kapalné H2O (Obrázek \(\PageIndex{1}\)).
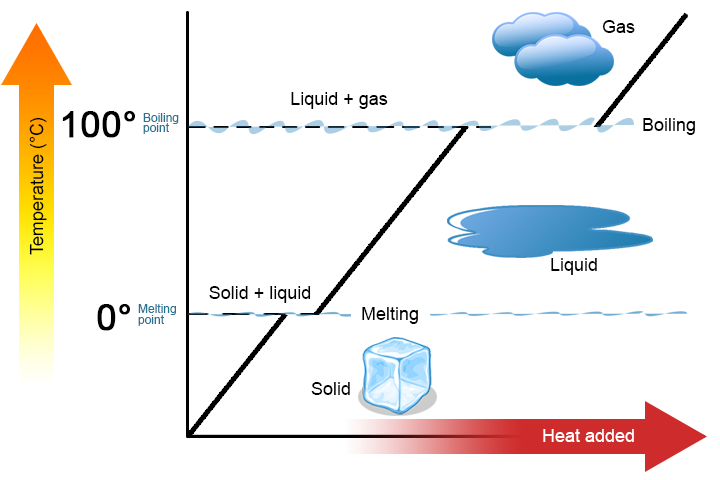
Vody, je dobré látku použít jako příklad, protože mnoho lidí jsou již obeznámeni s ním. Jiné látky mají také body tání a body varu.
za Druhé, jak je znázorněno na Obrázku \(\PageIndex{1}\), teplota látky se nemění jako látka přechází z jedné fáze do druhé. Jinými slovy, fázové změny jsou izotermické (izotermické znamená „konstantní teplota“). Opět zvažte H2O jako příklad. Pevná voda (led) může existovat na 0°C. Když je teplo přidané do ledu na 0°C, některé změny pevné fáze kapalinou, která je také na 0°C. Pamatujte si, že pevné a kapalné fáze H2O mohou koexistovat na 0°C. Teprve poté, co všechny pevné roztaje do kapaliny se přidáním tepla změnou teploty látky.
pro každou fázovou změnu látky existuje charakteristické množství tepla potřebné k provedení fázové změny na gram (nebo na mol) materiálu. Teplo fúze (ΔHfus) je množství tepla na gram (nebo na mol) potřebné pro změnu fáze, ke které dochází v bodě tání. Teplo odpařování (ΔHvap) je množství tepla na gram (nebo na mol) potřebné pro změnu fáze, ke které dochází v bodě varu. Pokud víte, že celkový počet gramů či molů materiálu, můžete použít ΔHfus nebo ΔHvap stanovení celkové teplo je převedeno na tání nebo tuhnutí pomocí těchto výrazů:
\
, kde \(n\) je počet molů a \(ΔH_{fus}\) je vyjádřena v energetické/mol nebo
\
, kde \(m\) je hmotnost v gramech a \(ΔH_{fus}\) je vyjádřena v energetické/gram.
pro varu nebo kondenzaci použijte tyto výrazy:
\
, kde \(n\) je počet molů) a \(ΔH_{vap}\) je vyjádřena v energetické/mol nebo
\
, kde \(m\) je hmotnost v gramech a \(ΔH_{vap}\) je vyjádřena v energetické/gram.
nezapomeňte, že změna fáze závisí na směru přenosu tepla. Pokud se teplo přenáší, pevné látky se stávají kapalinami a kapaliny se stávají pevnými látkami v bodech tání a varu. Pokud se teplo přenáší, kapaliny ztuhnou a plyny kondenzují na kapaliny. V těchto bodech nedochází ke změnám teploty, jak se odráží ve výše uvedených rovnicích.
tabulka \(\PageIndex{1}\) uvádí zahřívání fúze a odpařování některých běžných látek. Poznámka: jednotky na tato množství; při použití těchto hodnot v řešení problému, ujistěte se, že ostatní proměnné se ve výpočtu jsou vyjádřeny v jednotkách v souladu s jednotkami v konkrétní topí nebo ohřívá tání a odpařování.
Sublimace
k Dispozici je také změna fáze, kde solidní jde přímo na plyn.
\
Tato změna fáze se nazývá sublimace. Každá látka má charakteristické teplo sublimace spojené s tímto procesem. Například teplo sublimace (ΔHsub) H2O je 620 cal / g.
sublimací se setkáváme několika způsoby. Možná už znáte suchý led, což je prostě pevný oxid uhličitý (CO2). Při -78.5°C (-109°F), pevný oxid uhličitý, sublimes, měnící se přímo z pevné fáze do plynné fáze:
\
Pevný oxid uhličitý nazývá suchý led, protože to neprojde přes kapalné fáze. Místo toho to dělá přímo do plynné fáze. (Oxid uhličitý může existovat jako kapalina, ale pouze pod vysokým tlakem.) Suchý led má mnoho praktických použití, včetně dlouhodobého uchování lékařských vzorků.
i při teplotách pod 0°C se pevná látka H2O pomalu vznáší. Například, tenké vrstvy sněhu nebo námrazy na zemi může pomalu zmizí jako solidní H2O sublimes, i když venkovní teplota může být pod bodem mrazu vody. Podobně se kostky ledu v mrazáku mohou časem zmenšit. I když zmrazené, pevné voda pomalu sublimes, redepositing na chladnější chladící prvky v mrazáku, což vyžaduje pravidelné odmrazování (frost-volné mrazničky minimalizovat tento redeposition). Snížení teploty v mrazničce sníží potřebu odmrazování tak často.
Za podobných okolností, bude voda také sublime od zmrazených potravin (např. masa nebo zeleniny), což je neatraktivní, strakatý vzhled tzv. mrazáku. Není to opravdu „hořet“ a jídlo nemusí být nutně špatné, i když to vypadá nechutně. Spálení mrazničky lze minimalizovat snížením teploty mrazničky a těsným zabalením potravin, takže voda nemá žádný prostor pro vznešenost.
Concept Review cvičení
- vysvětlit, co se stane, když teplo proudí do nebo z látky v jejím bodu tání nebo bodu varu.
- jak se množství tepla potřebné pro změnu fáze vztahuje k hmotnosti látky?
- jaký je směr přenosu tepla ve vroucí vodě?
- jaký je směr přenosu tepla v mrazivé vodě?
- jaký je směr přenosu tepla při pocení?
odpovědi
1. Energie jde do změny fáze, ne teploty.
2. Množství tepla je konstantní na gram látky.
3. Var. Do vody se přidává teplo, aby se dostalo z kapalného stavu do plynného stavu.
4. Zmrazení. Teplo opouští systém, aby šlo z kapaliny na pevnou látku. Dalším způsobem, jak se na to podívat, je zvážit opačný proces tavení. Energie je spotřebována (endotermická) k roztavení ledu (pevná látka na kapalinu), takže opačný proces (kapalina na pevnou látku) musí být exotermní.
5. Pocení. Teplo se spotřebuje k odpařování vlhkosti na pokožce, což snižuje teplotu.
klíč s sebou
- s každou změnou fáze je spojena změna energie.
Cvičení
-
kolik energie je potřeba k roztavení 43.8 g Au na jeho bod tání 1,064°C?
-
kolik energie se uvolní, když 563.8 g NaCl ztuhne při teplotě tuhnutí 801°C?
-
jakou hmotnost ledu lze roztavit 558 cal energie?
-
jaké množství ethanolu (C2H5OH) v gramech může zmrazit při jeho tuhnutí pokud 1,225 cal tepla jsou odstraněny?
-
Co je teplo odpařování látky, pokud 10,776 cal jsou potřebné k odpařování 5.05 g? Vyjádřete svou konečnou odpověď v joulech na gram.
-
Pokud je pro odpařování vzorku, který má odpařovací teplo 137 cal/g, zapotřebí 1650 cal tepla, jaká je hmotnost vzorku?
-
jaké je teplo fúze vody v kaloriích na mol?
-
jaké je teplo odpařování benzenu (C6H6) v kaloriích na mol?
-
jaké je teplo odpařování zlata v kaloriích na mol?
-
jaké je teplo fúze železa v kaloriích na mol?
Odpovědi
-
670 cal
3. 6.98 g
4. 27.10 g
-
8,930 J / g
-
1,440 cal/mol
9. 80,600 cal / mol
10. 3,530 cal / mol
Leave a Reply