7.3: Phase Changes
Obiettivi formativi
- Determinare il calore associato a un cambiamento di fase.
La materia può esistere in uno dei diversi stati, tra cui uno stato gassoso, liquido o solido. La quantità di energia nelle molecole della materia determina lo stato della materia.
- Un gas è uno stato della materia in cui atomi o molecole hanno abbastanza energia per muoversi liberamente. Le molecole entrano in contatto l’una con l’altra solo quando si scontrano casualmente.
- Un liquido è uno stato della materia in cui atomi o molecole sono costantemente in contatto ma hanno abbastanza energia per continuare a cambiare le posizioni l’una rispetto all’altra.
- Un solido è uno stato della materia in cui atomi o molecole non hanno abbastanza energia per muoversi. Sono costantemente in contatto e in posizioni fisse l’una rispetto all’altra.
I seguenti sono i cambiamenti di stato:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- Se il calore viene aggiunto a una sostanza, ad esempio nella fusione, vaporizzazione e sublimazione, il processo è endotermico. In questo caso, il calore sta aumentando la velocità delle molecole che le causano muoversi più velocemente (esempi: solido a liquido; liquido a gas; solido a gas).
- Se il calore viene rimosso da una sostanza, ad esempio nel congelamento e nella condensazione, il processo è esotermico. In questo caso, il calore sta diminuendo la velocità delle molecole inducendole a muoversi più lentamente (esempi: da liquido a solido; da gas a liquido). Questi cambiamenti rilasciano calore all’ambiente circostante.
- La quantità di calore necessaria per cambiare un campione da solido a liquido sarebbe la stessa per invertire da liquido a solido. L’unica differenza è la direzione del trasferimento di calore.
Esempio \(\PageIndex{1}\)
Etichettare ciascuno dei seguenti processi come endotermico o esotermico.
- acqua che bolle
- ghiaccio che si forma su uno stagno
Soluzione
- endotermico: devi mettere una pentola d’acqua sul fornello e darle calore per far bollire l’acqua. Poiché stai aggiungendo calore / energia, la reazione è endotermica.
- esotermico-pensare di ghiaccio formando nel congelatore, invece. Metti l’acqua nel congelatore, che toglie il calore dall’acqua, per farlo congelare. Poiché il calore viene estratto dall’acqua, è esotermico. Il calore se ne sta andando.
Esercizio \(\PageIndex{1}\)
Etichettare ciascuno dei seguenti processi come endotermico o esotermico.
- condensazione del vapore acqueo
- fusione dell’oro
Risposta
a. esotermico
b. endotermico
Un cambiamento di fase è un processo fisico in cui una sostanza passa da una fase all’altra. Di solito il cambiamento si verifica quando si aggiunge o si rimuove il calore a una particolare temperatura, nota come punto di fusione o punto di ebollizione della sostanza. Il punto di fusione è la temperatura alla quale la sostanza passa da un solido a un liquido (o da un liquido a un solido). Il punto di ebollizione è la temperatura alla quale una sostanza passa da un liquido a un gas (o da un gas a un liquido). La natura del cambiamento di fase dipende dalla direzione del trasferimento di calore. Il calore che entra in una sostanza lo cambia da un solido a un liquido o da un liquido a un gas. La rimozione del calore da una sostanza cambia un gas in un liquido o un liquido in un solido.
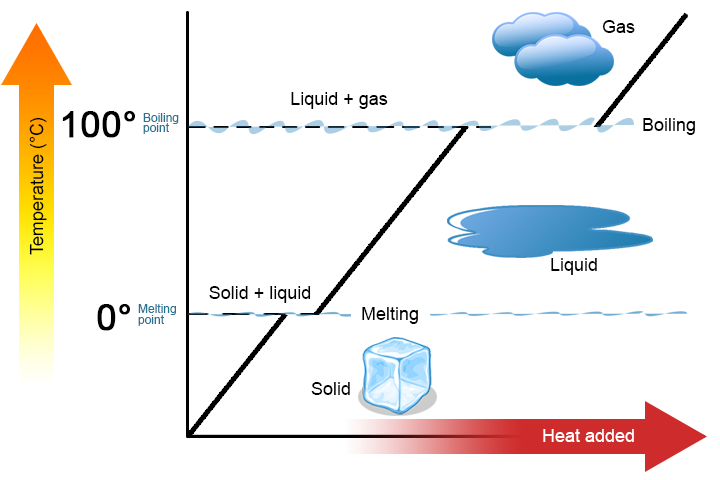
Vale la pena sottolineare due punti chiave. Innanzitutto, al punto di fusione o al punto di ebollizione di una sostanza, possono esistere contemporaneamente due fasi. Prendi l’acqua (H2O) come esempio. Sulla scala Celsius, H2O ha un punto di fusione di 0°C e un punto di ebollizione di 100°C. A 0°C, entrambe le fasi solide e liquide di H2O possono coesistere. Tuttavia, se viene aggiunto calore, parte del solido H2O si scioglierà e si trasformerà in H2O liquido. Se il calore viene rimosso, accade il contrario: parte dell’H2O liquido si trasforma in H2O solido. Un processo simile può verificarsi a 100°C: l’aggiunta di calore aumenta la quantità di H2O gassoso, mentre la rimozione di calore aumenta la quantità di H2O liquido (Figura \(\PageIndex{1}\)).
L’acqua è una buona sostanza da usare come esempio perché molte persone ne hanno già familiarità. Altre sostanze hanno punti di fusione e punti di ebollizione pure.
In secondo luogo, come mostrato nella figura \(\PageIndex{1}\), la temperatura di una sostanza non cambia quando la sostanza passa da una fase all’altra. In altre parole, i cambiamenti di fase sono isotermici (isotermico significa “temperatura costante”). Ancora una volta, considera H2O come esempio. L’acqua solida (ghiaccio) può esistere a 0°C. Se il calore viene aggiunto al ghiaccio a 0°C, alcuni dei solidi cambiano fase per rendere liquido, che è anche a 0°C. Ricorda, le fasi solido e liquido di H2O possono coesistere a 0°C. Solo dopo che tutto il solido si è fuso in liquido l’aggiunta di calore cambia la temperatura della sostanza.
Per ogni cambiamento di fase di una sostanza, esiste una quantità caratteristica di calore necessaria per eseguire il cambiamento di fase per grammo (o per mole) di materiale. Il calore di fusione (ΔHfus) è la quantità di calore per grammo (o per mole) necessaria per un cambiamento di fase che si verifica nel punto di fusione. Il calore di vaporizzazione (ΔHvap) è la quantità di calore per grammo (o per mole) necessaria per un cambiamento di fase che si verifica al punto di ebollizione. Se si conosce il numero totale di grammi o talpe del materiale, è possibile utilizzare il ΔHfus o il ΔHvap per determinare il totale del calore trasferito per la fusione o di solidificazione utilizzo di queste espressioni:
\
dove \(n\) è il numero di moli e \(ΔH_{fu}\) è espresso in energia/mole o
\
dove \(m\) è la massa in grammi e \(ΔH_{fu}\) è espresso in energia per grammo.
Per l’ebollizione o la condensazione, utilizzare queste espressioni:
\
dove \(n\) è il numero di moli) e \(ΔH_{vap}\) è espresso in energia/mole o
\
dove \(m\) è la massa in grammi e \(ΔH_{vap}\) è espresso in energia per grammo.
Ricorda che un cambiamento di fase dipende dalla direzione del trasferimento di calore. Se il calore si trasferisce, i solidi diventano liquidi e i liquidi diventano solidi rispettivamente nei punti di fusione e di ebollizione. Se il calore si trasferisce, i liquidi si solidificano e i gas si condensano in liquidi. In questi punti, non ci sono cambiamenti di temperatura come riflesso nelle equazioni di cui sopra.
Tabella \(\PageIndex{1}\) elenca i riscaldamenti di fusione e vaporizzazione per alcune sostanze comuni. Notare le unità su queste quantità; quando si utilizzano questi valori nella risoluzione dei problemi, assicurarsi che le altre variabili nel calcolo siano espresse in unità coerenti con le unità nelle manche specifiche o nelle manche di fusione e vaporizzazione.
Sublimazione
C’è anche un cambiamento di fase in cui un solido va direttamente a un gas:
\
Questo cambiamento di fase è chiamato sublimazione. Ogni sostanza ha un caratteristico calore di sublimazione associato a questo processo. Ad esempio, il calore di sublimazione (ΔHsub) di H2O è 620 cal/g.
Incontriamo la sublimazione in diversi modi. Potresti già avere familiarità con il ghiaccio secco, che è semplicemente anidride carbonica solida (CO2). A -78,5°C (-109°F), l’anidride carbonica solida sublima, passando direttamente dalla fase solida alla fase gassosa:
\
L’anidride carbonica solida è chiamata ghiaccio secco perché non passa attraverso la fase liquida. Invece, lo fa direttamente alla fase gassosa. (L’anidride carbonica può esistere come liquido ma solo ad alta pressione.) Il ghiaccio secco ha molti usi pratici, compresa la conservazione a lungo termine di campioni medici.
Anche a temperature inferiori a 0°C, l’H2O solido si sublimerà lentamente. Ad esempio, un sottile strato di neve o gelo sul terreno può lentamente scomparire come il solido H2O sublima, anche se la temperatura esterna può essere al di sotto del punto di congelamento dell’acqua. Allo stesso modo, i cubetti di ghiaccio in un congelatore possono diventare più piccoli nel tempo. Sebbene congelata, l’acqua solida sublima lentamente, ridepositando sugli elementi di raffreddamento più freddi del congelatore, il che richiede uno sbrinamento periodico (i congelatori senza gelo minimizzano questa rideposizione). Abbassare la temperatura in un congelatore ridurrà la necessità di scongelare più spesso.
In circostanze simili, l’acqua sarà anche sublime da cibi surgelati (ad esempio, carni o verdure), dando loro un aspetto poco attraente, screziato chiamato bruciatura da congelatore. Non è davvero una “bruciatura” e il cibo non è necessariamente andato male, anche se sembra poco appetitoso. La bruciatura del congelatore può essere ridotta al minimo abbassando la temperatura di un congelatore e avvolgendo strettamente gli alimenti in modo che l’acqua non abbia spazio per sublimare.
Esercizi di revisione del concetto
- Spiega cosa succede quando il calore scorre dentro o fuori da una sostanza nel suo punto di fusione o punto di ebollizione.
- In che modo la quantità di calore richiesta per un cambiamento di fase si riferisce alla massa della sostanza?
- Qual è la direzione del trasferimento di calore in acqua bollente?
- Qual è la direzione del trasferimento di calore nell’acqua di congelamento?
- Qual è la direzione del trasferimento di calore nella sudorazione?
Risposte
1. L’energia va a cambiare la fase, non la temperatura.
2. La quantità di calore è una costante per grammo di sostanza.
3. Bollente. Il calore viene aggiunto all’acqua per ottenerlo dallo stato liquido allo stato del gas.
4. Congelamento. Il calore sta uscendo dal sistema per passare da liquido a solido. Un altro modo per guardarlo è considerare il processo opposto di fusione. L’energia viene consumata (endotermica) per sciogliere il ghiaccio (da solido a liquido), quindi il processo opposto (da liquido a solido) deve essere esotermico.
5. Sudorazione. Il calore viene consumato per far evaporare l’umidità sulla pelle che abbassa la temperatura.
Key Takeaway
- C’è un cambiamento di energia associato a qualsiasi cambiamento di fase.
Esercizi
-
Quanta energia è necessaria per fondere 43,8 g di Au al suo punto di fusione di 1.064°C?
-
Quanta energia viene emessa quando 563.8 g di NaCl solidifica al suo punto di congelamento di 801°C?
-
Quale massa di ghiaccio può essere sciolta di 558 cal di energia?
-
Quanto etanolo (C2H5OH) in grammi può congelare al suo punto di congelamento se vengono rimossi 1.225 cal di calore?
-
Qual è il calore di vaporizzazione di una sostanza se sono necessari 10.776 cal per vaporizzare 5,05 g? Esprimi la tua risposta finale in joule per grammo.
-
Se sono necessari 1.650 cal di calore per vaporizzare un campione che ha un calore di vaporizzazione di 137 cal/g, qual è la massa del campione?
-
Qual è il calore della fusione dell’acqua in calorie per mole?
-
Qual è il calore della vaporizzazione del benzene (C6H6) in calorie per mole?
-
Qual è il calore della vaporizzazione dell’oro in calorie per mole?
-
Qual è il calore della fusione del ferro in calorie per mole?
Risposte
-
670 cal
3. 6,98 g
4. 27,10 g
-
8,930 J/g
-
1.440 cal/mol
9. 80.600 cal / mol
10. 3.530 cal / mol
Leave a Reply