7.3: zmiany fazowe
cele uczenia się
- określają ciepło związane ze zmianą fazową.
Materia może istnieć w jednym z kilku różnych stanów, w tym w stanie gazowym, ciekłym lub stałym. Ilość energii w cząsteczkach materii określa stan materii.
- gaz to stan materii, w którym atomy lub cząsteczki mają wystarczająco dużo energii, aby swobodnie się poruszać. Cząsteczki stykają się ze sobą tylko wtedy, gdy zderzają się losowo.
- ciecz jest stanem materii, w którym atomy lub cząsteczki są stale w kontakcie, ale mają wystarczająco dużo energii, aby zmieniać pozycje względem siebie.
- ciało stałe to stan materii, w którym atomy lub cząsteczki nie mają wystarczającej ilości energii do poruszania się. Są one stale w kontakcie i w stałych pozycjach względem siebie.
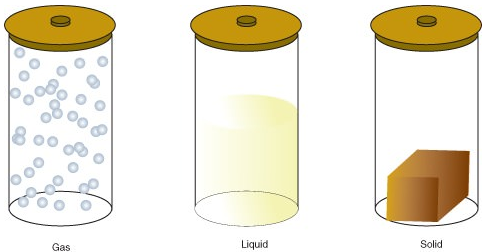
poniżej przedstawiono zmiany stanu:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- Jeśli do substancji dodaje się ciepło, takie jak topienie, parowanie i sublimacja, Proces jest endotermiczny. W tym przypadku ciepło zwiększa prędkość cząsteczek, powodując ich szybszy ruch (przykłady: ciało stałe do cieczy; ciecz do gazu; ciało stałe do gazu).
- jeśli ciepło jest usuwane z substancji, na przykład podczas zamrażania i kondensacji, proces ten ma charakter egzotermiczny. W tym przypadku ciepło zmniejsza prędkość cząsteczek, powodując ich wolniejszy ruch (przykłady: ciecz do ciała stałego; gaz do cieczy). Zmiany te uwalniają ciepło do otoczenia.
- ilość ciepła potrzebna do zmiany próbki z ciała stałego na ciecz byłaby taka sama, aby odwrócić się od cieczy do ciała stałego. Jedyną różnicą jest kierunek wymiany ciepła.
przykład \(\PageIndex{1}\)
każdy z następujących procesów należy oznaczyć jako endotermiczny lub egzotermiczny.
- gotowanie wody
- formowanie się lodu na stawie
roztwór
- endotermiczny – należy umieścić patelnię z wodą na piecu i podgrzać, aby woda się zagotowała. Ponieważ dodajesz ciepło/energię, reakcja jest endotermiczna.
- egzotermika-zamiast tego pomyśl o tworzeniu się lodu w zamrażarce. Wkładasz wodę do zamrażarki, która pobiera ciepło z wody, aby ją zamrozić. Ponieważ ciepło jest wyciągane z wody, jest egzotermiczne. Ciepło odchodzi.
ćwiczenie \(\PageIndex{1}\)
każdy z poniższych procesów należy oznaczyć jako endotermiczny lub egzotermiczny.
- kondensacja pary wodnej
- topienie złota
odpowiedź
A. egzotermiczna
b. endotermiczny
zmiana fazy to proces fizyczny, w którym substancja przechodzi z jednej fazy do drugiej. Zwykle zmiana występuje podczas dodawania lub usuwania ciepła w określonej temperaturze, znanej jako temperatura topnienia lub temperatura wrzenia substancji. Temperatura topnienia to temperatura, w której substancja przechodzi z ciała stałego do cieczy (lub z cieczy do ciała stałego). Temperatura wrzenia to temperatura, w której substancja przechodzi z cieczy do gazu (lub z gazu do cieczy). Charakter zmiany fazy zależy od kierunku wymiany ciepła. Ciepło przechodzące do substancji zmienia ją z ciała stałego w ciecz lub ciecz w gaz. Usunięcie ciepła z substancji zmienia gaz w ciecz lub ciecz w ciało stałe.
warto podkreślić dwa kluczowe punkty. Po pierwsze, w temperaturze topnienia lub wrzenia substancji, dwie fazy mogą istnieć jednocześnie. Weźmy jako przykład wodę (H2O). W skali Celsjusza H2O ma temperaturę topnienia 0 ° C i temperaturę wrzenia 100°C. W 0°C zarówno faza stała, jak i ciekła H2O mogą współistnieć. Jeśli jednak zostanie dodane ciepło, część stałego H2O stopi się i zamieni w ciekły H2O. Jeśli ciepło jest usuwane, dzieje się odwrotnie: część ciekłego H2O zamienia się w stały H2O. podobny proces może zachodzić w temperaturze 100°C: dodanie ciepła zwiększa ilość gazowego H2O, podczas gdy usunięcie ciepła zwiększa ilość ciekłego H2O (rysunek \(\PageIndex{1}\)).
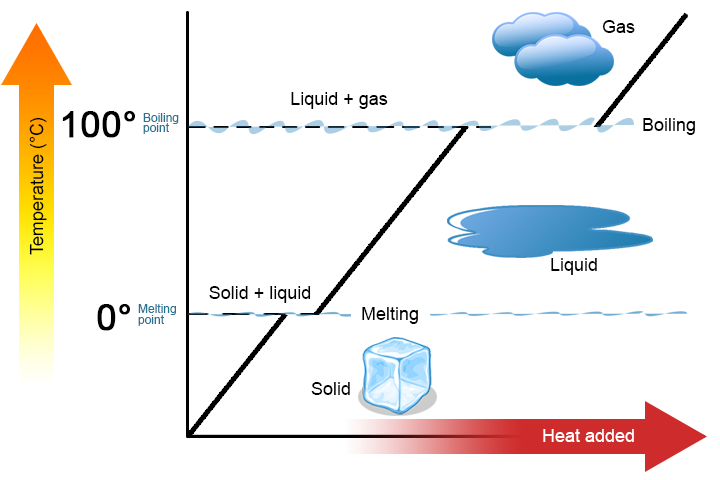
woda jest dobrą substancją do wykorzystania jako przykład, ponieważ wiele osób już ją zna. Inne substancje mają temperatury topnienia i wrzenia, jak również.
Po drugie, jak pokazano na rysunku \(\PageIndex{1}\), Temperatura substancji nie zmienia się, gdy substancja przechodzi z jednej fazy do drugiej. Innymi słowy, zmiany fazowe są izotermiczne (izoterma oznacza „stałą temperaturę”). Ponownie rozważmy H2O jako przykład. Woda stała (lód) może istnieć w temperaturze 0°C. Jeśli ciepło zostanie dodane do lodu w temperaturze 0°C, część fazy stałej zmienia się w ciecz, która również znajduje się w temperaturze 0°C. Pamiętaj, że fazy stałe i ciekłe H2O mogą współistnieć w temperaturze 0°C. dopiero po tym, jak całe ciało stałe stopi się w ciecz, dodanie ciepła zmienia temperaturę substancji.
dla każdej zmiany fazy substancji, istnieje charakterystyczna ilość ciepła potrzebna do przeprowadzenia zmiany fazy na gram (lub na mol) materiału. Ciepło fuzji (ΔHfus) to ilość ciepła na gram (lub na mol) wymagana do zmiany fazy, która występuje w temperaturze topnienia. Ciepło parowania (ΔHvap) to ilość ciepła na gram (lub na mol) wymagana do zmiany fazy, która występuje w temperaturze wrzenia. Jeśli znasz całkowitą liczbę gramów lub moli materiału, możesz użyć ΔHfus lub ΔHvap do określenia całkowitego ciepła przenoszonego do topienia lub krzepnięcia za pomocą następujących wyrażeń:
\
gdzie \(N\) jest liczbą moli i \(ΔH_{FUS}\) jest wyrażona w energii/mol lub
\
gdzie \(M\) jest masą w gramach i \(ΔH_{FUS}\) wyraża się w energii/gram.
do wrzenia lub kondensacji użyj tych wyrażeń:
\
gdzie \(n\) jest liczbą moli) i \(ΔH_{Vap}\) jest wyrażona w energii/mol lub
\
gdzie \(m\) jest masą w gramach i \(ΔH_{Vap}\) jest wyrażona w energii / gram.
pamiętaj, że zmiana fazy zależy od kierunku wymiany ciepła. Jeśli ciepło przenosi się, ciała stałe stają się cieczami, a ciecze stają się ciałami stałymi odpowiednio w temperaturze topnienia i wrzenia. Jeśli ciepło przenosi się, ciecze zestalają się, a gazy kondensują się w cieczach. W tych punktach nie ma zmian temperatury, co odzwierciedlają powyższe równania.
tabela \(\PageIndex{1}\) zawiera listę temperatur fuzji i odparowania niektórych popularnych substancji. Zwróć uwagę na jednostki na tych ilościach; kiedy używasz tych wartości w rozwiązywaniu problemów, upewnij się, że inne zmienne w obliczeniach są wyrażone w jednostkach zgodnych z jednostkami w konkretnych ogrzewaniach lub ogrzewaniach fuzji i waporyzacji.
Sublimacja
istnieje również zmiana fazy, w której ciało stałe przechodzi bezpośrednio do gazu:
\
ta zmiana fazy nazywa się sublimacją. Każda substancja ma charakterystyczne ciepło sublimacji związane z tym procesem. Na przykład ciepło sublimacji (ΔHsub) H2O wynosi 620 cal/g.
sublimację spotykamy na kilka sposobów. Być może znasz już suchy lód, który jest po prostu stałym dwutlenkiem węgla (CO2). W temperaturze -78,5°c (-109°F) stały dwutlenek węgla sublimuje, zmieniając się bezpośrednio z fazy stałej na fazę gazową:
\
stały dwutlenek węgla jest nazywany suchym lodem, ponieważ nie przechodzi przez fazę ciekłą. Zamiast tego, robi bezpośrednio do fazy gazowej. (Dwutlenek węgla może występować jako ciecz, ale tylko pod wysokim ciśnieniem.) Suchy lód ma wiele praktycznych zastosowań, w tym długoterminowe przechowywanie próbek medycznych.
nawet przy temperaturach poniżej 0°C, stałe H2O powoli się wysublimuje. Na przykład cienka warstwa śniegu lub szronu na Ziemi może powoli znikać, gdy stałe H2O sublimuje, nawet jeśli temperatura zewnętrzna może być poniżej temperatury zamarzania wody. Podobnie, kostki lodu w zamrażarce mogą się zmniejszać z czasem. Chociaż stała woda jest zamrożona, powoli sublimuje, ponownie osadzając się na chłodniejszych elementach chłodzenia zamrażarki, co wymaga okresowego rozmrażania (zamrażarki bez mrozu minimalizują tę zmianę). Obniżenie temperatury w zamrażarce zmniejszy potrzebę rozmrażania tak często.
w podobnych okolicznościach woda będzie również wysublimowana z mrożonek (np. mięs lub warzyw), nadając im nieatrakcyjny, Cętkowany wygląd zwany oparzeniem zamrażarki. Nie jest to naprawdę „oparzenie”, a jedzenie niekoniecznie poszło źle, chociaż wygląda nieapetycznie. Spalanie zamrażarki można zminimalizować, obniżając temperaturę zamrażarki i ciasno owijając żywność, aby woda nie miała miejsca do wysublimowania.
Concept Review ćwiczenia
- wyjaśnij, co się dzieje, gdy ciepło przepływa do lub z substancji w jej temperaturze topnienia lub wrzenia.
- w jaki sposób ilość ciepła potrzebna do zmiany fazy ma związek z masą substancji?
- jaki jest kierunek wymiany ciepła we wrzącej wodzie?
- jaki jest kierunek wymiany ciepła w zamarzającej wodzie?
- jaki jest kierunek wymiany ciepła w poceniu?
odpowiedzi
1. Energia przechodzi do zmiany fazy, a nie temperatury.
2. Ilość ciepła jest stała na gram substancji.
3. Gotowanie. Ciepło jest dodawane do wody, aby uzyskać go ze stanu ciekłego do stanu gazu.
4. Zamarzam. Ciepło wychodzi z systemu, aby przejść z cieczy do ciała stałego. Innym sposobem patrzenia na to jest rozważenie odwrotnego procesu topienia. Energia jest zużywana (endotermiczna) do stopienia lodu (ciało stałe do cieczy), więc proces odwrotny (ciecz do ciała stałego) musi być egzotermiczny.
5. Pocenie się. Ciepło jest zużywane, aby odparować wilgoć na skórze, co obniża temperaturę.
- z każdą zmianą fazy wiąże się zmiana energii.
ćwiczenia
-
ile energii potrzeba do stopienia 43,8 g Au w temperaturze topnienia 1064°c?
-
ile energii jest wydzielane gdy 563.8 g NaCl zestala się w temperaturze zamarzania 801°c?
-
jaką masę lodu można stopić o 558 cal energii?
-
ile etanolu (C2H5OH) w gramach może zamarznąć w punkcie zamarzania, jeśli usunie się 1,225 cala ciepła?
-
Jakie jest ciepło parowania substancji, jeśli do odparowania 5,05 g potrzeba 10,776 cal? Wyraź swoją ostateczną odpowiedź w dżulach na gram.
-
Jeśli do odparowania próbki, która ma ciepło odparowania 137 cal / g, jaka jest masa próbki?
-
Jakie jest ciepło fuzji wody w kaloriach na mol?
-
Jakie jest ciepło parowania benzenu (C6H6) w kaloriach na mol?
-
Jakie jest ciepło parowania złota w kaloriach na mol?
-
Jakie jest ciepło fuzji żelaza w kaloriach na mol?
-
670 kalorii
3. 6,98 G
4. 27,10 g
8,930 J / g
-
1440 Kal/mol
9. 80 600 Kal / mol
10. 3530 Kal / mol
10. 3530 Kal / mol
Leave a Reply