7.3: Faasimuutokset
oppimistavoitteet
- määrittävät faasimuutokseen liittyvän lämmön.
aine voi esiintyä yhdessä useista eri olomuodoista, mukaan lukien kaasu, neste tai kiinteä olomuoto. Energian määrä aineen molekyyleissä määrää aineen tilan.
- kaasu on aineen olomuoto, jossa atomeilla tai molekyyleillä on riittävästi energiaa liikkua vapaasti. Molekyylit joutuvat kosketuksiin toistensa kanssa vasta satunnaisesti törmätessään.
- neste on aineen olomuoto, jossa atomit tai molekyylit ovat jatkuvasti kosketuksissa, mutta niillä on tarpeeksi energiaa vaihtaakseen jatkuvasti asemiaan toisiinsa nähden.
- kiinteä aine on aineen olomuoto, jossa atomeilla tai molekyyleillä ei ole tarpeeksi energiaa liikkumiseen. Ne ovat jatkuvasti yhteydessä toisiinsa ja kiinteissä asennoissa toisiinsa nähden.
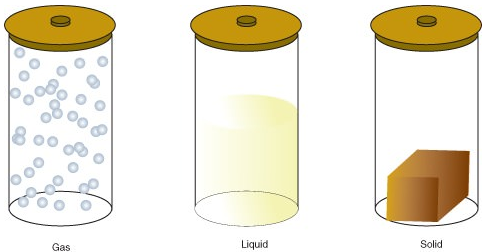
seuraavat ovat valtiomuutokset:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- Jos aineeseen lisätään lämpöä esimerkiksi sulamisessa, höyrystymisessä ja sublimoinnissa, prosessi on endoterminen. Tässä tapauksessa, lämpö lisää nopeutta molekyylien aiheuttaa ne liikkuvat nopeammin (esimerkkejä: kiinteä neste; neste kaasu; kiinteä kaasu).
- Jos jostakin aineesta poistuu lämpöä esimerkiksi jäätymisen ja tiivistymisen yhteydessä, prosessi on eksoterminen. Tässä tapauksessa, lämpö on vähentää nopeutta molekyylien aiheuttaa ne liikkuvat hitaammin (esimerkkejä: neste kiinteä; kaasu neste). Nämä muutokset vapauttavat lämpöä ympäristöön.
- näytteen muuttamiseen kiinteästä nesteeksi tarvittaisiin sama lämpömäärä, joka kääntyisi nesteestä kiinteäksi. Ainoa ero on lämmönsiirron suunta.
esimerkki \(\PageIndex{1}\)
merkitse jokainen seuraavista prosesseista endotermiseksi tai eksotermiseksi.
- vesi kiehuu
- jää muodostuu lampeen
liuos
- endoterminen – liedelle pitää laittaa pannu vettä ja antaa sen lämmetä, jotta vesi pääsee kiehumaan. Koska lisäät lämpöä / energiaa, reaktio on endoterminen.
- eksoterminen – ajattele sen sijaan, että pakastimeesi muodostuisi jäätä. Pakastimeen laitetaan vettä, joka ottaa lämpöä pois vedestä, jotta se jäätyy. Koska lämpöä vedetään vedestä, se on eksotermistä. Lämpö lähtee.
harjoitus \(\PageIndex{1}\)
merkitse jokainen seuraavista prosesseista endotermiseksi tai eksotermiseksi.
- vesihöyryn tiivistyminen
- kullan sulaminen
vastaus
a. eksoterminen
b. endoterminen
faasimuutos on fysikaalinen prosessi, jossa aine siirtyy faasista toiseen. Yleensä muutos tapahtuu, kun lisätään tai poistetaan lämpöä tietyssä lämpötilassa, joka tunnetaan aineen sulamispisteenä tai kiehumispisteenä. Sulamispiste on lämpötila, jossa aine siirtyy kiinteästä aineesta nesteeksi (tai nesteestä kiinteäksi). Kiehumispiste on lämpötila, jossa aine siirtyy nesteestä kaasuksi (tai kaasusta nesteeksi). Faasimuutoksen luonne riippuu lämmönsiirron suunnasta. Aineeseen menevä lämpö muuttaa sen kiinteästä nesteeksi tai nesteestä kaasuksi. Lämmön poistaminen aineesta muuttaa kaasun nesteeksi tai nesteen kiinteäksi.
kahta avainkohtaa kannattaa korostaa. Ensinnäkin aineen sulamispisteessä tai kiehumispisteessä voi olla kaksi faasia samanaikaisesti. Otetaan esimerkiksi vesi (H2O). Celsius-asteikolla H2O: n sulamispiste on 0°C ja kiehumispiste 100°C. 0°C: ssa sekä H2O: n kiinteä-että nestefaasi voivat esiintyä rinnakkain. Jos lämpöä kuitenkin lisätään, osa kiinteästä H2O: sta sulaa ja muuttuu nestemäiseksi H2O: ksi. Jos lämpö poistetaan, tapahtuu päinvastoin: osa nesteestä H2o muuttuu kiinteäksi H2O: ksi. samanlainen prosessi voi tapahtua 100°C: ssa: lämmön lisääminen lisää kaasumaisen H2O: n määrää, kun taas lämmön poistaminen lisää nesteen H2O: n määrää (Kuva \(\PageIndex{1}\)).
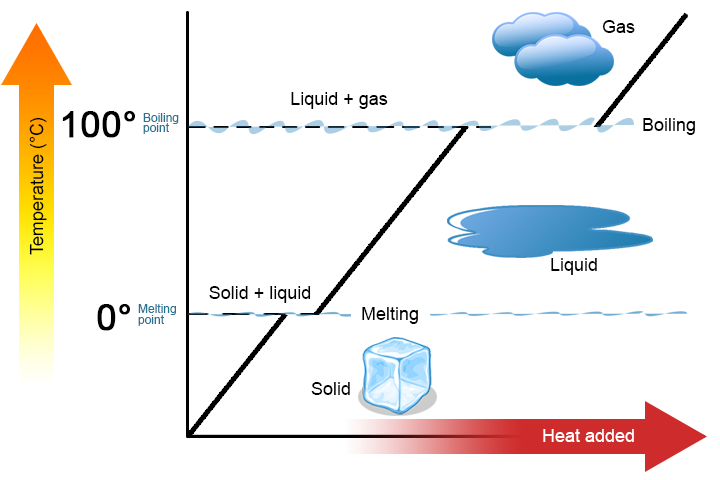
vesi on hyvä aine käytettäväksi esimerkkinä, koska se on monelle jo ennestään tuttu. Myös muilla aineilla on sulamispisteitä ja kiehumispisteitä.
toinen, kuten kuvassa \(\PageIndex{1}\), aineen lämpötila ei muutu aineen siirtyessä vaiheesta toiseen. Toisin sanoen faasimuutokset ovat isotermisiä (isoterminen tarkoittaa ”vakiolämpötilaa”). Harkitse jälleen H2O: ta esimerkkinä. Kiinteää vettä (jäätä) voi olla 0°C: ssa.jos jäähän lisätään lämpöä 0°C: ssa, osa kiinteästä muuttuu faasiksi tehdäkseen nestettä, joka on myös 0°C: ssa. muista, että H2O: n kiinteä-ja nestefaasit voivat elää rinnakkain 0°C: ssa. vasta kun kaikki kiinteä aine on sulanut nesteeksi, lämmön lisääminen muuttaa aineen lämpötilaa.
jokaiselle aineen faasimuutokselle on ominainen lämpömäärä, joka tarvitaan faasimuutoksen suorittamiseen grammaa (tai moolia) kohti. Fuusiolämpö (ΔHfus) on sulamispisteessä tapahtuvaan faasimuutokseen tarvittava lämpömäärä grammaa (tai moolia) kohti. Höyrystymislämpö (ΔHvap) on kiehumispisteessä tapahtuvaan faasimuutokseen tarvittava lämpömäärä grammaa (tai moolia) kohti. Jos tiedät materiaalin grammojen tai moolien kokonaismäärän, voit käyttää ΔHfus-tai ΔHvap-arvoa sulattamiseen tai jähmettymiseen siirrettävän kokonaislämmön määrittämiseen näitä lausekkeita käyttäen:
\
\
missä\ (n\) on moolien lukumäärä ja\ (ΔH_{fus}\) ilmaistaan energiana/moolina tai
\
missä\ (M\) on massa grammoina ja\ (ΔH_{FUS}\) ilmaistaan energiana / gramma.
kiehumiseen tai tiivistymiseen käytetään seuraavia ilmaisuja:
\
missä \(n\) on moolien lukumäärä) ja \(ΔH_{vap}\) ilmaistaan energiana/mooli tai
\
missä \(M\) on massa grammoina ja \(ΔH_{vap}\) ilmaistaan energiana / gramma.
muista, että faasimuutos riippuu lämmönsiirron suunnasta. Jos lämpö siirtyy, kiintoaineet muuttuvat nesteiksi ja nesteet kiinteiksi sulamis-ja kiehumispisteissä vastaavasti. Jos lämpö siirtyy pois, nesteet jähmettyvät ja kaasut tiivistyvät nesteiksi. Näissä kohdissa ei tapahdu lämpötilan muutoksia, jotka näkyvät yllä olevissa yhtälöissä.
taulukko \(\PageIndex{1}\) listaa joidenkin yleisten aineiden fuusio-ja höyrystymislämmöt. Huomioi näiden suureiden yksiköt; kun käytät näitä arvoja ongelmanratkaisussa, varmista, että muut laskentamuuttujat ilmaistaan yksikköinä, jotka ovat yhdenmukaisia tietyn lämpösumman tai fuusio-ja höyrystymislämmön yksiköiden kanssa.
sublimaatio
on myös faasimuutos, jossa kiinteä aine menee suoraan kaasuun:
\
tätä faasimuutosta kutsutaan sublimaatioksi. Jokaisella aineella on tähän prosessiin liittyvä sublimaatiolämpö. Esimerkiksi H2O: n sublimaation (ΔHsub) lämpö on 620 cal/g.
törmäämme sublimaatioon usealla tavalla. Saatat jo tuntea kuivajää, joka on yksinkertaisesti kiinteää hiilidioksidia (CO2). Lämpötilassa -78,5°C (-109°F) kiinteä hiilidioksidi sublimoituu muuttuen suoraan kiinteästä faasista kaasufaasiksi:
\
kiinteää hiilidioksidia kutsutaan kuivajääksi, koska se ei läpäise nestefaasia. Sen sijaan se tekee suoraan kaasufaasiin. (Hiilidioksidi voi esiintyä nesteenä, mutta vain korkeassa paineessa.) Kuivajäällä on monia käytännön käyttötarkoituksia, kuten lääketieteellisten näytteiden pitkäaikaissäilytys.
jopa alle 0°C: n lämpötiloissa kiinteä H2O sublimoituu hitaasti. Esimerkiksi ohut kerros lunta tai routaa maassa voi hiljalleen kadota kiinteän H2O: n sublimoituessa, vaikka ulkolämpötila voi olla veden jäätymispisteen alapuolella. Samoin pakastimessa olevat jääpalat voivat ajan myötä pienentyä. Vaikka kiinteä vesi on jäätynyt, se sublimoituu hitaasti ja kiinnittyy pakastimen kylmempiin jäähdytyselementteihin, mikä edellyttää säännöllistä sulatusta (jäätymättömät pakastimet minimoivat tämän uudelleensijoituksen). Lämpötilan alentaminen pakastimessa vähentää sulatustarvetta yhtä usein.
samanlaisissa olosuhteissa vesi myös ylevöityy pakastetuista elintarvikkeista (esim.lihoista tai vihanneksista), jolloin ne saavat epäviehättävän, kirjavan ulkonäön, jota kutsutaan pakastuspaloksi. Se ei varsinaisesti ole ”palanut”, eikä ruoka ole välttämättä mennyt pahaksi, vaikka se näyttää syömättömältä. Pakastimen palamista voi minimoida alentamalla pakastimen lämpötilaa ja paketoimalla ruoat tiiviisti, jotta vedellä ei ole tilaa ylevöitymiseen.
käsitteiden kertausharjoituksissa
- selitetään, mitä tapahtuu, kun lämpö virtaa aineeseen tai siitä ulos sen sulamispisteessä tai kiehumispisteessä.
- miten faasimuutokseen tarvittava lämpömäärä liittyy aineen massaan?
- mikä on lämmönsiirron suunta kiehuvassa vedessä?
- mikä on lämmönsiirron suunta jäätyvässä vedessä?
- mikä on lämmönsiirron suunta hikoilussa?
vastauksia
1. Energia menee faasin muuttamiseen, ei lämpötilan.
2. Lämmön määrä on vakio ainetta grammaa kohti.
3. Keittää. Veteen lisätään lämpöä, jotta se saadaan nestemäisestä olomuodosta kaasutilaan.
4. Jäätyminen. Lämpö poistuu elimistöstä siirtyäkseen nesteestä kiinteään. Toinen tapa tarkastella sitä on tarkastella päinvastaista sulamisprosessia. Energiaa kuluu (endoterminen) jään sulamiseen (kiinteästä nesteeseen), joten vastakkaisen prosessin (nesteestä kiinteään) on oltava eksoterminen.
5. Hikoilu. Lämpöä kuluu haihtua kosteutta iholle, joka alentaa lämpötilaa.
Key Takeaway
- mihin tahansa faasimuutokseen liittyy energiamuutos.
harjoitukset
-
kuinka paljon energiaa tarvitaan 43,8 g Au: n sulamiseen sen sulamispisteessä 1 064°C?
-
kuinka paljon energiaa vapautuu, kun 563.Jähmettyykö 8 g NaCl: ää sen jäätymispisteessä 801°C: ssa?
-
mikä massa jäätä voi sulattaa 558 cal energiaa?
-
kuinka paljon etanolia (C2H5OH) grammoina voi jäätymispisteessään jäätyä, jos 1,225 cal lämpöä poistuu?
-
mikä on aineen höyrystymislämpö, jos 5,05 g: n höyrystymiseen tarvitaan 10 776 Calia? Ilmaise lopullinen vastauksesi jouleina grammaa kohti.
-
Jos tarvitaan 1 650 cal lämpöä höyrystämään näyte, jonka höyrystymislämpö on 137 cal / g, mikä on näytteen massa?
-
mikä on veden fuusiolämpö kaloreina moolia kohti?
-
mikä on bentseenin (C6H6) höyrystymislämpö kaloreina moolia kohti?
-
mikä on kullan höyrystymisen lämpö kaloreina moolia kohti?
-
mikä on raudan fuusiolämpö kaloreina moolia kohti?
vastauksia
-
670 cal
3. 6, 98 g
4. 27,10 g
-
8 930 J/g
-
1 440 cal/mol
9. 80 600 cal / mol
10. 3 530 cal / mol
Leave a Reply