7.3:위상 변화
학습 목표
- 결정하는 열과 관련된 위상을 변경합니다.
문제에 존재할 수 있는 하나의 몇 가지 다른 국 포함하여,가스,액체 또는 고체 상태에 있습니다. 물질의 분자에있는 에너지의 양은 물질의 상태를 결정합니다.
- 가스는 원자 또는 분자가 자유롭게 움직일 수있는 충분한 에너지를 가지고있는 물질의 상태입니다. 분자들은 무작위로 충돌 할 때만 서로 접촉합니다.
- 액체 물질의 상태에서의 원자나 분자가 지속적으로 접촉하지만 충분한 에너지 계속 변화하는 위치에 상대적인 중 하나다.
- 고체는 원자 또는 분자가 이동하기에 충분한 에너지를 갖지 않는 물질의 상태입니다. 그들은 끊임없이 접촉하고 서로 상대적으로 고정 된 위치에 있습니다.
상태의 변화는 다음과 같습니다:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- 경우 열 추가되는 물질 등으로서 용융,증발,승화 프로세스는 흡열. 이 경우,열은 분자의 속도를 증가시켜 더 빠르게 움직입니다(예:고체 대 액체;액체 대 가스;고체 대 가스).
- 동결 및 응축과 같은 물질로부터 열이 제거되면 그 과정은 발열 성입니다. 이 경우,열을 줄이는 속도로 분자들을 일으키는 그들을 이동하는 느린(예:액체,가스를 액체). 이러한 변화는 주변으로 열을 방출합니다.
- 샘플을 고체에서 액체로 바꾸는 데 필요한 열의 양은 액체에서 고체로 역전하는 것과 같습니다. 유일한 차이점은 열전달의 방향입니다.
Example\(\PageIndex{1}\)
흡열 또는 발열로 다음 각 과정을 라벨링하십시오.
- 물 끓는
- 얼음을 형성하는 연못에
솔루션
- 원-을 넣어야 합 팬의 물고 그것을 열을 얻기 위해서 물을 끓입니다. 열/에너지를 추가하고 있기 때문에 반응은 흡열입니다.
- 발열-대신 냉동실에 얼음이 형성되는 것을 생각하십시오. 당신은 물 밖으로 열을 받아 냉동실에 물을가합니다. 열이 물 밖으로 빠져 나가기 때문에 발열 성입니다. 열이 떠나고 있습니다.
Exercise\(\PageIndex{1}\)
다음 각 과정을 흡열 또는 발열로 라벨링하십시오.
- 물 증기 응축
- 금 녹는
대답
a.발열
b. 흡열
상 변화는 물질이 한 상에서 다른 상으로가는 물리적 과정입니다. 일반적으로 변화는 물질의 융점 또는 끓는점으로 알려진 특정 온도에서 열을 가하거나 제거 할 때 발생합니다. 융점은 물질이 고체에서 액체(또는 액체에서 고체)로가는 온도입니다. 끓는점은 물질이 액체에서 기체로(또는 기체에서 액체로)이동하는 온도입니다. 상 변화의 본질은 열 전달의 방향에 달려있다. 물질에 들어가는 열은 그것을 고체에서 액체 또는 액체에서 기체로 변화시킵니다. 물질에서 열을 제거하면 기체가 액체로 변하거나 액체가 고체로 변합니다.
두 가지 핵심 사항을 강조 할 가치가 있습니다. 첫째,물질의 융점 또는 끓는점에서 두 상이 동시에 존재할 수 있습니다. 예를 들어 물(H2O)을 섭취하십시오. 섭씨 스케일에서 H2O 는 0°C 의 융점과 100°C 의 끓는점을 가지며 0°C 에서 h2o 의 고체 및 액상 모두 공존 할 수 있습니다. 그러나 열이 가해지면 고체 H2O 의 일부가 녹아서 액체 H2O 로 변할 것입니다. 는 경우 열이 제거되고,반대가 됩의 일부 액체 H2O 으로 솔리드 H2O. 비슷한 프로세스에서 발생할 수 있습 100°C 추가하는 열의 양이 증가합 가스 H2O 제거하면서 열을 증가한 금액을 액체 H2O(그림\(\PageIndex{1}\)).
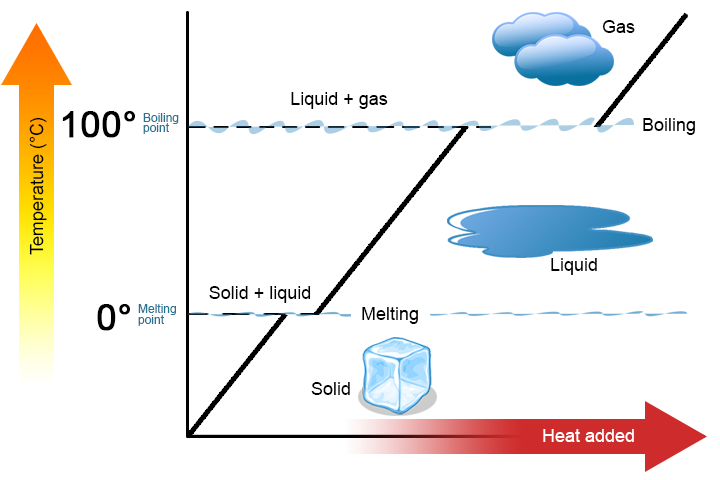
물 좋은 물질을 사용하여 예를 들어 같기 때문에 많은 사람들이 이미 잘 알고 있습니다. 다른 물질뿐만 아니라 녹는 점과 끓는점이 있습니다.
번 그림과 같\(\PageIndex{1}\),온도의 물질이 변하지 않으로 물질에서 한 단계니다. 즉,상 변화는 등온(등온은”일정한 온도”를 의미 함)입니다. 다시 H2O 를 예로 들어 보겠습니다. 단단한 물(얼음)에 존재할 수 있 0°C 면 열을 추가하 얼음에는 0°C,일부 의 솔리드의 변화 단계를 액체,도에는 0°C 에 기억,고체 및 액체상의 H2O 공존할 수 있는 0°C 에서만 모든 고체에는 녹으로 액체는 또한 열의 변경의 온도는 물질이다.
각 단계에서의 변화,물질이 특징적인 양의 열을 수행하는 데 필요한 단계 변화에 따 g(또는 몰)의 소재입니다. 융합의 열(ΔHfus)은 융점에서 발생하는 상 변화에 필요한 그램 당(또는 몰당)열의 양입니다. 기화 열(ΔHvap)은 끓는점에서 발생하는 상 변화에 필요한 그램 당(또는 몰당)열의 양입니다. 당신이 알고 있는 경우 총 수의 그램 또는 몰수 재료의 사용할 수 있습니다 ΔHfus 나 ΔHvap 을 결정합 열 전송되는 용융 또는 응고를 사용하여 이러한 표현:
\
어디\(n\n)수의 몰수 및\(ΔH_{fus}\)는 표현에서의 에너지/몰 또는
\
어디\(m\) 질량에서 그램\(ΔH_{fus}\)는 표현에서의 에너지/그램.
비등 또는 응축의 경우 다음 식을 사용하십시오:
\
어디\(n\n)수의 몰수)그리고\(ΔH_{vap}\)는 표현에서의 에너지/몰 또는
\
어디\(m\)질량에서 그램\(ΔH_{vap}\)는 표현에서의 에너지/그램.
위상 변화는 열전달의 방향에 의존한다는 것을 기억하십시오. 열이 안으로 전달되면 고체는 액체가되고 액체는 각각 용융점과 끓는점에서 고체가됩니다. 열이 밖으로 전달되면 액체가 고형화되고 가스가 액체로 응축됩니다. 이 시점에서 위의 방정식에 반영된 온도 변화는 없습니다.
표\(\PageIndex{1}\)는 일부 일반적인 물질에 대한 융합 및 기화의 가열을 나열합니다. 참고:단위에서 이러한 때에 이러한 값을 사용하여 문제를 해결하는지 확인하는 다른 변수를 계산하는 단위로 표시하는 일관된 세부사항들이 동일하다면 제품을 특정 가열하는 가열기의 융합과 증발.
승화
있 단계 변화가 고체 간에 직접스:
\
이 단계 변화라는 승화. 각 물질은이 과정과 관련된 승화의 특징적인 열을 가지고 있습니다. 예를 들어,h2o 의 승화(ΔHsub)의 열은 620cal/g 입니다.
우리는 여러 가지 방법으로 승화를 만난다. 당신은 이미 단순히 고체 이산화탄소(CO2)인 드라이 아이스에 익숙 할 수 있습니다. 에 -78.5°C(-109°F)에서 단단한 이산화탄소 고상하게 하고,변화하는에서 직접 고체상하 가스 단계:
\
단단한 이산화탄소라는 드라이 아이스하지 않기 때문에 패스를 통해 액체 단계입니다. 대신,그것은 가스 단계에 직접 않습니다. (이산화탄소는 액체로 존재할 수 있지만 고압 하에서 만 존재할 수 있습니다.)드라이 아이스는 의료 샘플의 장기 보존을 포함하여 많은 실용적인 용도를 가지고 있습니다.
0°c 이하의 온도에서도 고체 H2O 는 천천히 숭고한 것입니다. 예를 들어,얇은 층의 눈 또는 서리가 지상에서 천천히 사라질로 솔리드 H2O 고상하게 하고,도 외부온도 수 있 아래 어는점의 물. 마찬가지로 냉동실의 얼음 조각은 시간이 지남에 따라 작아 질 수 있습니다. 냉동지만,고체 물 천천히 고상하게 하고,redepositing 에서 차가운 냉각 요소의 냉동고,필요로 하는 정기적인 녹(프로스트-무료 냉장고 최소화하는 이토 타). 냉동실의 온도를 낮추면 자주 해동 할 필요가 줄어 듭니다.
유사한 상황에서,물 또한 숭고한 냉동 식품(예를들면,고기 또 야채),그들에게 매력적이,얼룩덜룩한 외관이라는 냉장고 구울 수 있습니다. 그것은 실제로”화상”이 아니며 식량이 식욕을 돋 우지 않는 것처럼 보이지만 음식은 반드시 나 빠지지 않았습니다. 냉장고 화상을 최소화할 수 있습니다 낮추는 냉동실의 온도와 식품을 포장 단단히 그래서 물이 없는 공간을 숭고한다.
개념을 검토 연
- 무엇인지 설명할 때 일어나는 열 흐름으로 또는 밖으로 물질에서의 녹는점이나 끓는점이다.
- 상 변화에 필요한 열의 양은 물질의 질량과 어떤 관련이 있습니까?
- 끓는 물에서의 열 전달 방향은 무엇입니까?
- 얼어 붙은 물에서의 열 전달 방향은 무엇입니까?
- 땀에 있는 열전달의 방향은 무엇입니까?
답변
1. 에너지는 온도가 아닌 위상을 변화시키는 것으로 들어갑니다.
2. 열의 양은 물질 그램 당 일정합니다.
3. 끓는. 액체 상태에서 가스 상태로 그것을 얻기 위해 물에는 열이 추가되고 있습니다.
4. 얼어 붙다. 액체에서 고체로 이동하기 위해 열이 시스템을 빠져 나가고 있습니다. 그것을 보는 또 다른 방법은 용해의 반대 과정을 고려하는 것입니다. 에너지 소비(원)에 녹여 얼음(단단한 액체)그 반대의 과정(액체 단단한)를 발열.
5. 땀을 흘리다. 열은 당신의 온도를 낮추는 당신의 피부에 습기를 증발하기 위하여 소모된다.
키 테이크 아웃
- 있는 에너지 변화와 관련된 모든 단계 변경합니다.
연습
-
1,064°C 의 융점에서 43.8g 의 Au 를 녹이기 위해 얼마나 많은 에너지가 필요합니까?
-
563 때 얼마나 많은 에너지가 꺼져 있는지.8g 의 NaCl 은 801°C 의 빙점에서 응고됩니까?
-
558cal 의 에너지로 어떤 질량의 얼음을 녹일 수 있습니까?
-
1,225cal 의 열이 제거되면 그램 단위의 에탄올(C2H5OH)이 빙점에서 얼어 붙을 수 있습니까?
-
5.05g 을 기화시키기 위해 10,776cal 이 필요한 경우 물질의 기화 열은 얼마입니까? 최종 답변을 그램 당 줄 단위로 표현하십시오.
-
경우 1,650cal 열의가 필요한 증발 샘플을 갖는 열의 증발 137cal/g,무엇입 대량의 샘플?
-
몰당 칼로리로 물 융합의 열은 무엇입니까?
-
몰 당 칼로리로 벤젠(C6H6)의 기화 열은 무엇입니까?
-
몰 당 칼로리로 금의 기화 열은 무엇입니까?
-
몰당 칼로리로 철분 융합의 열은 무엇입니까?
답변
-
670cal
3. 6.98 지
4. 27.10g
-
8,930J/g
-
1,440cal/mol
9. 80,600cal/mol
10. 쨩챌쨋첨쨉챤쨌쨔첩짙
Leave a Reply