7.3: modificări de fază
obiective de învățare
- determină căldura asociată cu o schimbare de fază.
Materia poate exista într-una din mai multe stări diferite, inclusiv în stare gazoasă, lichidă sau solidă. Cantitatea de energie din moleculele materiei determină starea materiei.
- un gaz este o stare a materiei în care atomii sau moleculele au suficientă energie pentru a se mișca liber. Moleculele intră în contact între ele numai atunci când se ciocnesc aleatoriu.
- un lichid este o stare a materiei în care atomii sau moleculele sunt în permanență în contact, dar au suficientă energie pentru a menține pozițiile în schimbare unul față de celălalt.
- un solid este o stare de materie în care atomii sau moleculele nu au suficientă energie pentru a se mișca. Ele sunt în permanență în contact și în poziții fixe unul față de celălalt.
următoarele sunt modificările de stare:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- dacă se adaugă căldură unei substanțe, cum ar fi topirea, vaporizarea și sublimarea, procesul este endotermic. În acest caz, căldura crește viteza moleculelor care le determină să se miște mai repede (Exemple: solid la lichid; lichid la gaz; solid la gaz).
- dacă căldura este îndepărtată dintr-o substanță, cum ar fi înghețarea și condensarea, atunci procesul este exoterm. În acest caz, căldura scade viteza moleculelor, determinându-le să se miște mai lent (Exemple: lichid în solid; gaz în lichid). Aceste schimbări eliberează căldură în împrejurimi.
- cantitatea de căldură necesară pentru a schimba o probă de la solid la lichid ar fi aceeași pentru a inversa de la lichid la solid. Singura diferență este direcția transferului de căldură.
Example \(\PageIndex{1}\)
etichetați fiecare dintre următoarele procese ca endoterme sau exoterme.
- apă clocotită
- gheață care se formează pe un iaz
soluție
- endotermic – trebuie să puneți o tigaie cu apă pe aragaz și să-i dați căldură pentru a face apa să fiarbă. Deoarece adăugați căldură / energie, reacția este endotermică.
- exotermă-gândiți-vă la formarea gheții în congelator. Puneți apă în congelator, care scoate căldura din apă, pentru a o face să înghețe. Deoarece căldura este scoasă din apă, este exotermă. Căldura pleacă.
Exercise \(\PageIndex{1}\)
etichetați fiecare dintre următoarele procese ca endoterme sau exoterme.
- condensarea vaporilor de apă
- topirea aurului
răspuns
a. exotermă
b. o schimbare de fază este un proces fizic în care o substanță trece de la o fază la alta. De obicei, schimbarea are loc atunci când se adaugă sau se îndepărtează căldura la o anumită temperatură, cunoscută sub numele de punctul de topire sau punctul de fierbere al substanței. Punctul de topire este temperatura la care substanța trece de la un solid la un lichid (sau de la un lichid la un solid). Punctul de fierbere este temperatura la care o substanță trece de la un lichid la un gaz (sau de la un gaz la un lichid). Natura schimbării de fază depinde de direcția transferului de căldură. Căldura care intră într-o substanță o schimbă de la un solid la un lichid sau un lichid la un gaz. Îndepărtarea căldurii dintr-o substanță schimbă un gaz într-un lichid sau un lichid într-un solid.
două puncte cheie merită subliniate. În primul rând, la punctul de topire sau punctul de fierbere al unei substanțe, două faze pot exista simultan. Luați apă (H2O) ca exemplu. Pe scara Celsius, H2O are un punct de topire de 0% C și un punct de fierbere de 100% C. la 0% C, atât fazele solide, cât și cele lichide ale H2O pot coexista. Cu toate acestea, dacă se adaugă căldură, o parte din H2O solid se va topi și se va transforma în H2O lichid. Dacă căldura este îndepărtată, se întâmplă contrariul: o parte din lichidul H2O se transformă în H2O solid. un proces similar poate avea loc la 100 de centi C: adăugarea de căldură crește cantitatea de H2O gazos, în timp ce îndepărtarea căldurii crește cantitatea de lichid H2O (figura \(\PageIndex{1}\)).
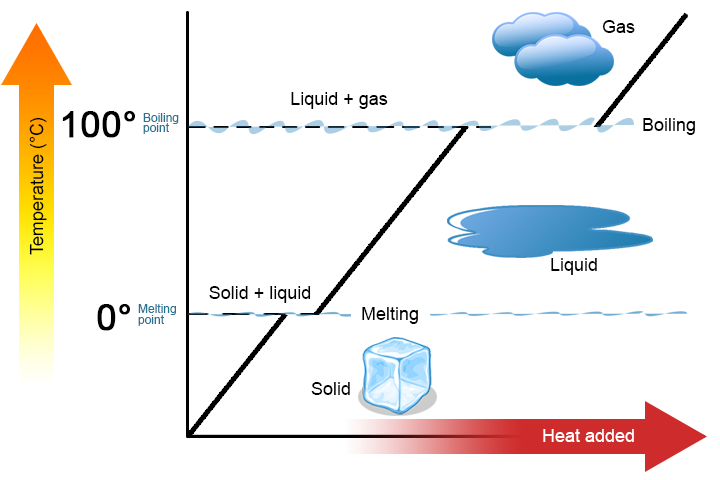
apa este o substanță bună de utilizat ca exemplu, deoarece mulți oameni sunt deja familiarizați cu ea. Alte substanțe au, de asemenea, puncte de topire și puncte de fierbere.
În al doilea rând, așa cum se arată în figura \(\PageIndex{1}\), temperatura unei substanțe nu se schimbă pe măsură ce substanța trece de la o fază la alta. Cu alte cuvinte, schimbările de fază sunt izoterme (izoterme înseamnă „temperatură constantă”). Din nou, luați în considerare H2O ca exemplu. Apa solida (gheata) poate exista la 0% C. Daca se adauga caldura in gheata la 0% C, o parte din faza solida se schimba pentru a face lichid, care este, de asemenea, la 0% C. amintiti-va, fazele solide si lichide ale H2O pot coexista la 0% C. numai dupa ce tot solidul s-a topit in lichid, adaugarea caldurii schimba temperatura substantei.
pentru fiecare schimbare de fază a unei substanțe, există o cantitate caracteristică de căldură necesară pentru a efectua schimbarea de fază pe gram (sau pe mol) de material. Căldura de fuziune (Xiff) este cantitatea de căldură pe gram (sau pe mol) necesară pentru o schimbare de fază care are loc la punctul de topire. Căldura de vaporizare (Xvhvap) este cantitatea de căldură pe gram (sau pe mol) necesară pentru o schimbare de fază care are loc la punctul de fierbere. Dacă cunoașteți numărul total de grame sau de moli de material, puteți utiliza valorile de la SEC sau SEC pentru a determina căldura totală transferată pentru topire sau solidificare folosind următoarele expresii:
\
unde \(N\) este numărul de moli și \(SEC_{fus}\) este exprimat în energie/moli sau
\
unde \(m\) este masa în grame și \(SEC_{fus}\) se exprimă în energie/gram.
pentru fierbere sau condensare, utilizați aceste expresii:
\
unde \(n\) este numărul de moli) și \(XVH_{vap}\) este exprimat în energie/mol sau
\
unde \(m\) este masa în grame și \(XVH_{vap}\) este exprimat în energie / gram.
amintiți-vă că o schimbare de fază depinde de direcția transferului de căldură. Dacă se transferă căldura, solidele devin lichide, iar lichidele devin solide la punctele de topire și, respectiv, la fierbere. Dacă căldura se transferă, lichidele se solidifică și gazele se condensează în lichide. În aceste puncte, nu există modificări ale temperaturii, așa cum se reflectă în ecuațiile de mai sus.
tabelul \(\PageIndex{1}\) enumeră căldurile de fuziune și vaporizare pentru unele substanțe comune. Rețineți unitățile pe aceste cantități; când utilizați aceste valori în rezolvarea problemelor, asigurați-vă că celelalte variabile din calculul dvs. sunt exprimate în unități în concordanță cu unitățile din încălzirile specifice sau încălzirile de fuziune și vaporizare.
sublimare
există, de asemenea, o schimbare de fază în care un solid merge direct la un gaz:
\
această schimbare de fază se numește sublimare. Fiecare substanță are o căldură caracteristică de sublimare asociată cu acest proces. De exemplu, căldura de sublimare (X-X-X) a lui H2O este de 620 cal/g.
întâlnim sublimarea în mai multe moduri. Este posibil să fiți deja familiarizați cu gheața uscată, care este pur și simplu dioxid de carbon solid (CO2). La -78.5 c (-109 F), dioxidul de carbon solid sublimează, trecând direct de la faza solidă la faza gazoasă:
\
dioxidul de carbon Solid se numește gheață uscată, deoarece nu trece prin faza lichidă. În schimb, se face direct la faza gazoasă. (Dioxidul de Carbon poate exista ca lichid, dar numai sub presiune ridicată.) Gheața uscată are multe utilizări practice, inclusiv conservarea pe termen lung a probelor medicale.
chiar și la temperaturi sub 0 centimetric C, H2O solid se va sublima încet. De exemplu, un strat subțire de zăpadă sau îngheț pe sol poate dispărea încet pe măsură ce solidul H2O sublimează, chiar dacă temperatura exterioară poate fi sub punctul de îngheț al apei. În mod similar, cuburile de gheață dintr-un congelator se pot micșora în timp. Deși înghețată, apa solidă sublimează încet, redepozitând elementele de răcire mai reci ale congelatorului, ceea ce necesită dezghețarea periodică (congelatoarele fără îngheț minimizează această redepunere). Scăderea temperaturii într-un congelator va reduce necesitatea dezghețării la fel de des.
în circumstanțe similare, apa va sublima și din alimentele congelate (de exemplu, carne sau legume), oferindu-le un aspect neatractiv, pătat, numit arsură la congelator. Nu este într-adevăr o „arsură”, iar mâncarea nu a mers neapărat rău, deși pare neapetitantă. Arderea congelatorului poate fi minimizată prin scăderea temperaturii congelatorului și prin împachetarea alimentelor strâns, astfel încât apa să nu aibă spațiu de sublimat.
exerciții de revizuire a conceptului
- explicați ce se întâmplă atunci când căldura curge în sau dintr-o substanță la punctul de topire sau punctul de fierbere.
- cum se raportează cantitatea de căldură necesară pentru o schimbare de fază la masa substanței?
- care este direcția transferului de căldură în apă clocotită?
- care este direcția transferului de căldură în apa înghețată?
- care este direcția transferului de căldură în transpirație?
răspunsuri
1. Energia intră în schimbarea fazei, nu a temperaturii.
2. Cantitatea de căldură este o constantă pe gram de substanță.
3. Fierbere. Se adaugă căldură în apă pentru ao obține de la starea lichidă la starea de gaz.
4. Îngheț. Căldura iese din sistem pentru a trece de la lichid la solid. O altă modalitate de a o privi este de a lua în considerare procesul opus de topire. Energia este consumată (endotermică) pentru a topi gheața (solidă în lichid), astfel încât procesul opus (lichid în solid) trebuie să fie exoterm.
5. Transpirație. Căldura este consumată pentru a evapora umezeala de pe piele, ceea ce vă scade temperatura.
cheie Takeaway
- există o schimbare de energie asociată cu orice schimbare de fază.
exerciții
-
câtă energie este necesară pentru a topi 43,8 g de ua la punctul său de topire de 1.064 unktc?
-
câtă energie este emisă atunci când 563.8 g de NaCl se solidifică la punctul său de îngheț de 801 CTF C?
-
Ce masă de gheață poate fi topită cu 558 cal de energie?
-
cât de mult etanol (C2H5OH) în grame poate îngheța la punctul său de îngheț dacă se elimină 1.225 cal de căldură?
-
care este căldura de vaporizare a unei substanțe dacă sunt necesare 10.776 cal pentru a vaporiza 5,05 g? Exprimați răspunsul final în jouli pe gram.
-
Dacă sunt necesare 1.650 cal de căldură pentru a vaporiza o probă care are o căldură de vaporizare de 137 cal / g, care este masa probei?
-
care este căldura de fuziune a apei în calorii pe mol?
-
care este căldura de vaporizare a benzenului (C6H6) în calorii pe mol?
-
care este căldura de vaporizare a aurului în calorii pe mol?
-
care este căldura de fuziune a fierului în calorii pe mol?
răspunsuri
-
670 cal
3. 6, 98 g
4. 27,10 g
-
8930 J/g
-
1440 cal/mol
9. 80.600 cal/mol
10. 3,530 cal / mol
Leave a Reply