7.3: Changements de phase
Objectifs d’apprentissage
- Déterminer la chaleur associée à un changement de phase.
La matière peut exister dans l’un de plusieurs états différents, y compris un état gazeux, liquide ou solide. La quantité d’énergie dans les molécules de matière détermine l’état de la matière.
- Un gaz est un état de la matière dans lequel les atomes ou les molécules ont suffisamment d’énergie pour se déplacer librement. Les molécules entrent en contact les unes avec les autres uniquement lorsqu’elles entrent en collision de manière aléatoire.
- Un liquide est un état de la matière dans lequel des atomes ou des molécules sont constamment en contact mais ont suffisamment d’énergie pour continuer à changer de position les uns par rapport aux autres.
- Un solide est un état de la matière dans lequel les atomes ou les molécules n’ont pas assez d’énergie pour se déplacer. Ils sont constamment en contact et dans des positions fixes les uns par rapport aux autres.
Voici les changements d’état:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- Si de la chaleur est ajoutée à une substance, par exemple lors de la fusion, de la vaporisation et de la sublimation, le processus est endothermique. Dans ce cas, la chaleur augmente la vitesse des molécules qui les font se déplacer plus rapidement (exemples: solide à liquide; liquide à gaz; solide à gaz).
- Si la chaleur est éliminée d’une substance, par exemple lors de la congélation et de la condensation, le processus est exothermique. Dans ce cas, la chaleur diminue la vitesse des molécules qui les ralentissent (exemples: liquide à solide; gaz à liquide). Ces changements libèrent de la chaleur dans l’environnement.
- La quantité de chaleur nécessaire pour changer un échantillon de solide en liquide serait la même pour passer du liquide au solide. La seule différence est la direction du transfert de chaleur.
Exemple \(\PageIndex{1}\)
Étiquetez chacun des processus suivants comme endothermique ou exothermique.
- eau bouillante
- formation de glace sur un étang
Solution
- endothermique – vous devez mettre une casserole d’eau sur la cuisinière et lui donner de la chaleur pour faire bouillir l’eau. Parce que vous ajoutez de la chaleur / de l’énergie, la réaction est endothermique.
- exothermique – pensez plutôt à la formation de glace dans votre congélateur. Vous mettez de l’eau dans le congélateur, qui évacue la chaleur de l’eau, pour la faire geler. Parce que la chaleur est extraite de l’eau, elle est exothermique. La chaleur s’en va.
Exercice \(\PageIndex{1}\)
Étiquetez chacun des processus suivants comme endothermique ou exothermique.
- condensation de vapeur d’eau
- fusion de l’or
Réponse
a.exothermique
b.
Un changement de phase est un processus physique dans lequel une substance passe d’une phase à une autre. Habituellement, le changement se produit lors de l’ajout ou de l’élimination de la chaleur à une température particulière, connue sous le nom de point de fusion ou de point d’ébullition de la substance. Le point de fusion est la température à laquelle la substance passe d’un solide à un liquide (ou d’un liquide à un solide). Le point d’ébullition est la température à laquelle une substance passe d’un liquide à un gaz (ou d’un gaz à un liquide). La nature du changement de phase dépend de la direction du transfert de chaleur. La chaleur qui pénètre dans une substance la fait passer d’un solide à un liquide ou d’un liquide à un gaz. L’élimination de la chaleur d’une substance transforme un gaz en liquide ou un liquide en solide.
Deux points clés méritent d’être soulignés. Premièrement, au point de fusion ou d’ébullition d’une substance, deux phases peuvent exister simultanément. Prenez l’eau (H2O) comme exemple. Sur l’échelle Celsius, H2O a un point de fusion de 0 ° C et un point d’ébullition de 100 ° C. À 0 ° C, les phases solide et liquide de H2O peuvent coexister. Cependant, si de la chaleur est ajoutée, une partie de l’H2O solide fondra et se transformera en H2O liquide. Si la chaleur est éliminée, c’est le contraire qui se produit: une partie du H2O liquide se transforme en H2O solide. Un processus similaire peut se produire à 100 ° C: l’ajout de chaleur augmente la quantité de H2O gazeux, tandis que l’élimination de la chaleur augmente la quantité de H2O liquide (Figure\(\PageIndex{1}\)).
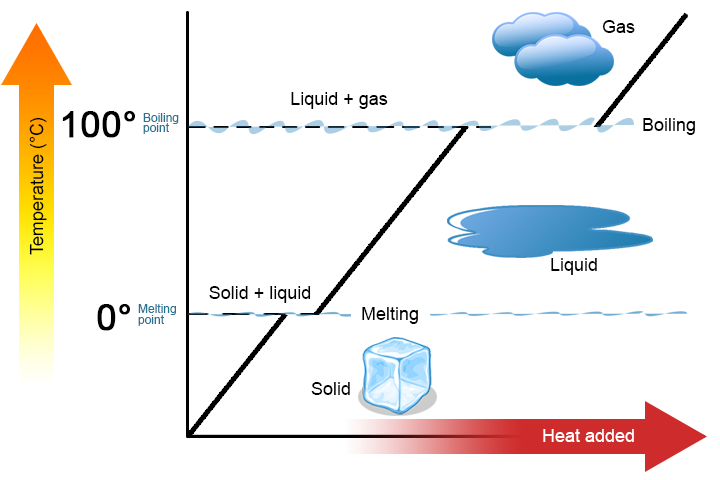
L’eau est une bonne substance à utiliser comme exemple car beaucoup de gens la connaissent déjà. D’autres substances ont également des points de fusion et des points d’ébullition.
Deuxièmement, comme le montre la figure \(\PageIndex{1}\), la température d’une substance ne change pas lorsque la substance passe d’une phase à l’autre. En d’autres termes, les changements de phase sont isothermes (isotherme signifie « température constante”). Encore une fois, considérez H2O comme un exemple. L’eau solide (glace) peut exister à 0 ° C. Si de la chaleur est ajoutée à la glace à 0 ° C, une partie du solide change de phase pour devenir liquide, qui est également à 0 ° C. Rappelez-vous, les phases solide et liquide de H2O peuvent coexister à 0 ° C. Ce n’est qu’après que tout le solide a fondu en liquide que l’ajout de chaleur modifie la température de la substance.
Pour chaque changement de phase d’une substance, il existe une quantité caractéristique de chaleur nécessaire pour effectuer le changement de phase par gramme (ou par mole) de matériau. La chaleur de fusion (ΔHfus) est la quantité de chaleur par gramme (ou par mole) nécessaire pour un changement de phase qui se produit au point de fusion. La chaleur de vaporisation (ΔHvap) est la quantité de chaleur par gramme (ou par mole) nécessaire pour un changement de phase qui se produit au point d’ébullition. Si vous connaissez le nombre total de grammes ou de moles de matériau, vous pouvez utiliser le ΔHfus ou le ΔHvap pour déterminer la chaleur totale transférée pour la fusion ou la solidification en utilisant ces expressions:
\
où \(n \) est le nombre de moles et \(ΔH_{fus}\) est exprimé en énergie / mole ou
\
où \(m \) est la masse en grammes et \(ΔH_{fus} \) est exprimée en énergie/gramme.
Pour l’ébullition ou la condensation, utilisez ces expressions:
\
où \(n\) est le nombre de moles) et \(ΔH_{vap}\) est exprimé en énergie / mole ou
\
où \(m\) est la masse en grammes et \(ΔH_{vap}\) est exprimé en énergie / gramme.
Rappelez-vous qu’un changement de phase dépend de la direction du transfert de chaleur. Si la chaleur y est transférée, les solides deviennent des liquides et les liquides deviennent des solides aux points de fusion et d’ébullition, respectivement. Si la chaleur se transfère, les liquides se solidifient et les gaz se condensent en liquides. À ces points, il n’y a pas de changements de température comme le reflètent les équations ci-dessus.
Le tableau \(\PageIndex{1}\) répertorie les chaleurs de fusion et de vaporisation de certaines substances courantes. Notez les unités sur ces grandeurs; lorsque vous utilisez ces valeurs dans la résolution de problèmes, assurez-vous que les autres variables de votre calcul sont exprimées en unités cohérentes avec les unités des chaleurs spécifiques ou des chaleurs de fusion et de vaporisation.
Sublimation
Il y a aussi un changement de phase où un solide va directement à un gaz :
\
Ce changement de phase est appelé sublimation. Chaque substance a une chaleur caractéristique de sublimation associée à ce processus. Par exemple, la chaleur de sublimation (ΔHsub) de H2O est de 620 cal /g.
Nous rencontrons la sublimation de plusieurs manières. Vous connaissez peut-être déjà la glace carbonique, qui est simplement du dioxyde de carbone solide (CO2). À -78,5 ° C (-109 ° F), le dioxyde de carbone solide se sublime, passant directement de la phase solide à la phase gazeuse:
\
Le dioxyde de carbone solide est appelé glace carbonique car il ne traverse pas la phase liquide. Au lieu de cela, il le fait directement à la phase gazeuse. (Le dioxyde de carbone peut exister sous forme liquide mais uniquement sous haute pression.) La glace carbonique a de nombreuses utilisations pratiques, y compris la conservation à long terme des échantillons médicaux.
Même à des températures inférieures à 0°C, l’H2O solide se sublime lentement. Par exemple, une fine couche de neige ou de givre au sol peut disparaître lentement à mesure que le H2O solide se sublime, même si la température extérieure peut être inférieure au point de congélation de l’eau. De même, les glaçons dans un congélateur peuvent devenir plus petits avec le temps. Bien que gelée, l’eau solide se sublime lentement, se redéposant sur les éléments de refroidissement plus froids du congélateur, ce qui nécessite un dégivrage périodique (les congélateurs sans gel minimisent cette redéposition). Abaisser la température dans un congélateur réduira le besoin de décongeler aussi souvent.
Dans des circonstances similaires, l’eau se sublimera également des aliments surgelés (par exemple, des viandes ou des légumes), ce qui leur donnera un aspect marbré et peu attrayant appelé brûlure de congélation. Ce n’est pas vraiment une « brûlure”, et la nourriture n’a pas nécessairement mal tourné, même si elle semble peu appétissante. La brûlure au congélateur peut être minimisée en abaissant la température du congélateur et en enveloppant les aliments de manière hermétique afin que l’eau n’ait pas d’espace pour se sublimer.
Des exercices d’examen du concept
- Expliquent ce qui se passe lorsque de la chaleur pénètre ou sort d’une substance à son point de fusion ou d’ébullition.
- Comment la quantité de chaleur requise pour un changement de phase est-elle liée à la masse de la substance?
- Quelle est la direction du transfert de chaleur dans l’eau bouillante?
- Quelle est la direction du transfert de chaleur dans l’eau glacée?
- Quelle est la direction du transfert de chaleur dans la transpiration?
Réponses
1. L’énergie entre dans la modification de la phase, pas de la température.
2. La quantité de chaleur est une constante par gramme de substance.
3. Bouillant. De la chaleur est ajoutée à l’eau pour la faire passer de l’état liquide à l’état gazeux.
4. Congélation. La chaleur sort du système pour passer du liquide au solide. Une autre façon de le regarder est de considérer le processus inverse de fusion. L’énergie est consommée (endothermique) pour faire fondre la glace (solide à liquide), de sorte que le processus inverse (liquide à solide) doit être exothermique.
5. Transpiration. La chaleur est consommée pour évaporer l’humidité de votre peau, ce qui abaisse votre température.
Clé à emporter
- Il y a un changement d’énergie associé à tout changement de phase.
Exercices
-
Quelle quantité d’énergie est nécessaire pour faire fondre 43,8 g d’Au à son point de fusion de 1 064°C?
-
Combien d’énergie est dégagée lorsque 563.8 g de NaCl se solidifie à son point de congélation de 801°C ?
-
Quelle masse de glace peut être fondue par 558 cal d’énergie?
-
Quelle quantité d’éthanol (C2H5OH) en grammes peut geler à son point de congélation si 1 225 cal de chaleur sont éliminés?
-
Quelle est la chaleur de vaporisation d’une substance si 10 776 cal sont nécessaires pour vaporiser 5,05 g? Exprimez votre réponse finale en joules par gramme.
-
Si 1 650 cal de chaleur sont nécessaires pour vaporiser un échantillon dont la chaleur de vaporisation est de 137 cal/g, quelle est la masse de l’échantillon?
-
Quelle est la chaleur de fusion de l’eau en calories par mole?
-
Quelle est la chaleur de vaporisation du benzène (C6H6) en calories par mole?
-
Quelle est la chaleur de vaporisation de l’or en calories par mole?
-
Quelle est la chaleur de fusion du fer en calories par mole?
Réponses
-
670 cal
3. 6,98 g
4. 27,10 g
-
8 930 J/g
-
1 440 cal/mol
9. 80 600 cal/mol
10. 3 530 cal/mol
Leave a Reply