7.3: Cambios de fase
Objetivos de aprendizaje
- Determinar el calor asociado con un cambio de fase.
La materia puede existir en uno de varios estados diferentes, incluyendo un estado gaseoso, líquido o sólido. La cantidad de energía en moléculas de materia determina el estado de la materia.
- Un gas es un estado de la materia en el que los átomos o moléculas tienen suficiente energía para moverse libremente. Las moléculas entran en contacto unas con otras solo cuando chocan aleatoriamente.
- Un líquido es un estado de la materia en el que átomos o moléculas están en contacto constante, pero tienen suficiente energía para seguir cambiando de posición en relación entre sí.
- Un sólido es un estado de la materia en el que los átomos o moléculas no tienen suficiente energía para moverse. Están en contacto constante y en posiciones fijas en relación entre sí.
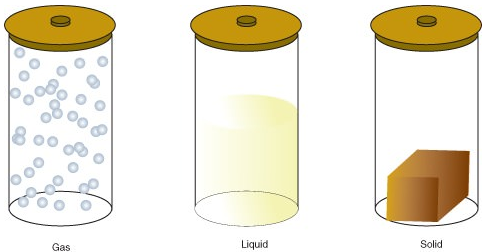
los siguientes son Los cambios de estado:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- Si el calor a una sustancia, como en la fusión, vaporización y sublimación, el proceso es endotérmico. En este caso, el calor aumenta la velocidad de las moléculas haciendo que se muevan más rápido (ejemplos: sólido a líquido; líquido a gas; sólido a gas).
- Si se elimina calor de una sustancia, como en la congelación y la condensación, el proceso es exotérmico. En este caso, el calor disminuye la velocidad de las moléculas haciendo que se muevan más lentamente (ejemplos: líquido a sólido; gas a líquido). Estos cambios liberan calor al entorno.
- La cantidad de calor necesaria para cambiar una muestra de sólido a líquido sería la misma para revertir de líquido a sólido. La única diferencia es la dirección de transferencia de calor.
Ejemplo \(\pageIndex{1}\)
Etiqueta cada uno de los siguientes procesos como endotérmico o exotérmico.
- el agua hirviendo
- formación de hielo en un estanque
Solución
- endotérmica – se debe colocar un recipiente con agua en la estufa y darle calor con el fin de obtener el agua a hervir. Debido a que está agregando calor/energía, la reacción es endotérmica.
- exotérmico: piense en la formación de hielo en su congelador. Pones agua en el congelador, que elimina el calor del agua, para que se congele. Debido a que el calor se extrae del agua, es exotérmico. El calor se va.
Ejercicio \ (\pageIndex{1}\)
Etiquete cada uno de los siguientes procesos como endotérmicos o exotérmicos.
- condensación de vapor de agua
- fusión de oro
Respuesta
a. exotérmica
b. endotérmico
Un cambio de fase es un proceso físico en el que una sustancia pasa de una fase a otra. Por lo general, el cambio se produce al agregar o eliminar calor a una temperatura particular, conocida como el punto de fusión o el punto de ebullición de la sustancia. El punto de fusión es la temperatura a la cual una sustancia pasa de un sólido a un líquido o de líquido a sólido). El punto de ebullición es la temperatura a la que una sustancia pasa de un líquido a un gas (o de un gas a un líquido). La naturaleza del cambio de fase depende de la dirección de la transferencia de calor. El calor que entra en una sustancia la cambia de un sólido a un líquido o de un líquido a un gas. Al eliminar el calor de una sustancia, un gas se convierte en líquido o un líquido en sólido.
Cabe destacar dos puntos clave. En primer lugar, en el punto de fusión o de ebullición de una sustancia, pueden existir dos fases simultáneamente. Tome el agua (H2O) como ejemplo. En la escala Celsius, el H2O tiene un punto de fusión de 0 ° C y un punto de ebullición de 100°C. A 0°C, pueden coexistir las fases sólida y líquida del H2O. Sin embargo, si se agrega calor, parte del H2O sólido se derretirá y se convertirá en H2O líquido. Si se elimina el calor, sucede lo contrario: parte del H2O líquido se convierte en H2O sólido. Un proceso similar puede ocurrir a 100°C: agregar calor aumenta la cantidad de H2O gaseoso, mientras que eliminar el calor aumenta la cantidad de H2O líquido (Figura \(\pageIndex{1}\)).
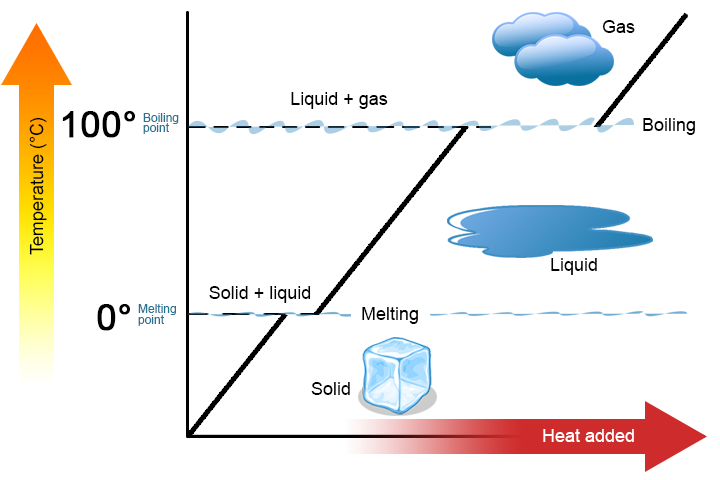
El agua es una buena sustancia para usar como ejemplo porque muchas personas ya están familiarizadas con ella. Otras sustancias también tienen puntos de fusión y de ebullición.
En segundo lugar, como se muestra en la figura \(\pageIndex{1}\), la temperatura de una sustancia no cambia a medida que la sustancia pasa de una fase a otra. En otras palabras, los cambios de fase son isotérmicos (isotérmicos significa «temperatura constante»). Una vez más, considere el H2O como un ejemplo. El agua sólida (hielo) puede existir a 0°C. Si se agrega calor al hielo a 0°C, parte del sólido cambia de fase para hacer líquido, que también está a 0°C. Recuerde, las fases sólida y líquida del H2O pueden coexistir a 0°C. Solo después de que todo el sólido se haya derretido en líquido, la adición de calor cambia la temperatura de la sustancia.
Para cada cambio de fase de una sustancia, hay una cantidad característica de calor necesaria para realizar el cambio de fase por gramo (o por mol) de material. El calor de fusión (ΔHfus) es la cantidad de calor por gramo (o por mol) requerida para un cambio de fase que ocurre en el punto de fusión. El calor de vaporización (ΔHvap) es la cantidad de calor por gramo (o por mol) necesaria para un cambio de fase que se produce en el punto de ebullición. Si conoce el número total de gramos o moles de material, puede usar el ΔHfus o el ΔHvap para determinar el calor total que se transfiere para fundir o solidificar utilizando estas expresiones:
\
donde \(n\) es el número de moles y \(ΔH_{fus}\) se expresa en energía/mol o
\
donde \(m\) es la masa en gramos y \(ΔH_{fus}\) se expresa en energía/gramo.
Para la ebullición o condensación, utilice estas expresiones:
\
donde \(n\) es el número de moles) y \(ΔH_{vap}\) se expresa en energía/mol o
\
donde \(m\) es la masa en gramos y \(ΔH_{vap}\) se expresa en energía/gramo.
Recuerde que un cambio de fase depende de la dirección de la transferencia de calor. Si el calor se transfiere, los sólidos se convierten en líquidos, y los líquidos se convierten en sólidos en los puntos de fusión y ebullición, respectivamente. Si el calor se transfiere, los líquidos se solidifican y los gases se condensan en líquidos. En estos puntos, no hay cambios en la temperatura como se refleja en las ecuaciones anteriores.
La tabla \(\pageIndex{1}\) enumera los calores de fusión y vaporización de algunas sustancias comunes. Nota: las unidades en estas cantidades; al utilizar estos valores en la resolución de problemas, asegúrese de que las otras variables en su cálculo se expresa en unidades consistentes con las unidades de los calores específicos o los calores de fusión y vaporización.
la Sublimación
también Hay un cambio de fase cuando un sólido pasa directamente a un gas:
\
Este cambio de fase se llama sublimación. Cada sustancia tiene un calor característico de sublimación asociado con este proceso. Por ejemplo, el calor de sublimación (ΔHsub) de H2O es de 620 cal/g.
Nos encontramos con la sublimación de varias maneras. Es posible que ya esté familiarizado con el hielo seco, que es simplemente dióxido de carbono sólido (CO2). A -78,5°C (-109°F), el dióxido de carbono sólido se sublima, cambiando directamente de la fase sólida a la fase gaseosa:
\
El dióxido de carbono sólido se llama hielo seco porque no pasa a través de la fase líquida. En cambio, lo hace directamente a la fase gaseosa. (El dióxido de carbono puede existir como líquido, pero solo bajo alta presión.) El hielo seco tiene muchos usos prácticos, incluida la conservación a largo plazo de muestras médicas.
Incluso a temperaturas inferiores a 0°C, el H2O sólido se sublimará lentamente. Por ejemplo, una capa delgada de nieve o escarcha en el suelo puede desaparecer lentamente a medida que el H2O sólido se sublima, a pesar de que la temperatura exterior puede estar por debajo del punto de congelación del agua. Del mismo modo, los cubitos de hielo en un congelador pueden reducirse con el tiempo. Aunque está congelada, el agua sólida se sublima lentamente y se vuelve a depositar en los elementos de refrigeración más fríos del congelador, lo que requiere descongelación periódica (los congeladores sin heladas minimizan esta redeposición). Bajar la temperatura en un congelador reducirá la necesidad de descongelar con tanta frecuencia.
En circunstancias similares, el agua también se sublimará de los alimentos congelados (por ejemplo, carnes o verduras), dándoles un aspecto poco atractivo y moteado llamado quemadura por congelador. No es realmente una «quemadura», y la comida no necesariamente se ha estropeado, aunque parece poco apetecible. La quema en el congelador se puede minimizar bajando la temperatura del congelador y envolviendo los alimentos con fuerza para que el agua no tenga espacio para sublimar.
Ejercicios de revisión conceptual
- Explican lo que sucede cuando el calor entra o sale de una sustancia en su punto de fusión o punto de ebullición.
- ¿Cómo se relaciona la cantidad de calor necesaria para un cambio de fase con la masa de la sustancia?
- ¿Cuál es la dirección de transferencia de calor en agua hirviendo?
- ¿Cuál es la dirección de transferencia de calor en el agua congelada?
- ¿Cuál es la dirección de transferencia de calor en la sudoración?
Respuestas
1. La energía va a cambiar la fase, no la temperatura.
2. La cantidad de calor es constante por gramo de sustancia.
3. Hervir. Se está agregando calor al agua para que pase del estado líquido al estado gaseoso.
4. Congelación. El calor sale del sistema para pasar de líquido a sólido. Otra forma de verlo es considerar el proceso opuesto de fusión. La energía se consume (endotérmica) para derretir el hielo (sólido a líquido), por lo que el proceso opuesto (líquido a sólido) debe ser exotérmico.
5. Sudoración. El calor se consume para evaporar la humedad de la piel, lo que reduce la temperatura.
Conclusión Clave
- Hay un cambio de energía asociado con ningún cambio de fase.
Ejercicios
-
¿Cuánta energía se necesita para fundir 43,8 g de Ua en su punto de fusión de 1.064°C?
-
Cuánta energía se emite cuando 563.8 g de NaCl se solidifican en su punto de congelación de 801 ° C?
-
¿Qué masa de hielo se puede derretir con 558 cal de energía?
-
¿Cuánto etanol (C2H5OH) en gramos puede congelarse en su punto de congelación si se eliminan 1.225 cal de calor?
-
¿Cuál es el calor de vaporización de una sustancia si se requieren 10.776 cal para vaporizar 5,05 g? Exprese su respuesta final en julios por gramo.
-
Si se requieren 1.650 cal de calor para vaporizar una muestra que tiene un calor de vaporización de 137 cal / g, ¿cuál es la masa de la muestra?
-
¿Cuál es el calor de fusión del agua en calorías por mol?
-
¿Cuál es el calor de vaporización del benceno (C6H6) en calorías por mol?
-
¿Cuál es el calor de vaporización de oro en calorías por mol?
-
¿Cuál es el calor de fusión del hierro en calorías por mol?
Respuestas
-
670 cal
3. 6,98 g
4. 27.10 g
-
8,930 J/g
-
1,440 cal/mol
9. 80.600 cal / mol
10. 3,530 cal/mol
Leave a Reply