7.3: alterações de fase
objectivos de aprendizagem
- determina o calor associado a uma alteração de fase.
a matéria pode existir em um de vários estados diferentes, incluindo um estado gasoso, líquido ou sólido. A quantidade de energia nas moléculas da matéria determina o estado da matéria.um gás é um estado de matéria no qual átomos ou moléculas têm energia suficiente para se moverem livremente. As moléculas entram em contacto umas com as outras apenas quando colidem aleatoriamente. um líquido é um estado de matéria no qual átomos ou moléculas estão constantemente em contato, mas têm energia suficiente para manter as posições em mudança em relação um ao outro. um sólido é um estado da matéria no qual átomos ou moléculas não têm energia suficiente para se mover. Eles estão constantemente em contato e em posições fixas em relação um ao outro.
as seguintes são as mudanças de Estado:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- Se o calor é adicionado a uma substância, tal como na fusão, a vaporização e a sublimação, o processo é endothermic. Neste caso, o calor está aumentando a velocidade das moléculas fazendo com que elas se movam mais rápido (exemplos: sólido para líquido; líquido para gás; sólido para gás).se o calor for removido de uma substância, tal como na congelação e condensação, o processo é exotérmico. Neste caso, o calor está diminuindo a velocidade das moléculas fazendo com que elas se movam mais lentamente (exemplos: líquido para sólido; gás para líquido). Estas alterações libertam calor para os arredores.
- a quantidade de calor necessária para mudar uma amostra de sólido para líquido seria a mesma para reverter de líquido para sólido. A única diferença é a direção da transferência de calor.
exemplo \(\PageIndex{1}\)
rotular cada um dos seguintes processos como endotérmico ou exotérmico.
- água fervente
- gelo se formando em uma lagoa
Solução
- endothermic – você deve colocar uma panela de água no fogão e dar-lhe calor, a fim de obter a água para ferver. Porque você está adicionando calor / energia, a reação é endotérmica.exotérmico-pense na formação de gelo no seu congelador. Você coloca água no congelador, que tira calor da água, para que ela congele. Porque o calor está a ser retirado da água, é exotérmico. O calor está a sair.
exercício \(\PageIndex{1}\)
rotular cada um dos seguintes processos como endotérmico ou exotérmico.
- condensação de vapor de água
- de fusão do ouro
Resposta
um. exotérmica
b. endotérmico
uma mudança de fase é um processo físico no qual uma substância vai de uma fase para outra. Normalmente, a mudança ocorre quando se adiciona ou remove calor a uma determinada temperatura, conhecida como ponto de fusão ou ponto de ebulição da substância. O ponto de fusão é a temperatura a que a substância vai de um sólido a um líquido (ou de um líquido a um sólido). O ponto de ebulição é a temperatura a que uma substância vai de um líquido para um gás (ou de um gás para um líquido). A natureza da mudança de fase depende da direção da transferência de calor. O calor que entra numa substância muda-a de um sólido para um líquido ou um líquido para um gás. A remoção do calor de uma substância muda um gás para um líquido ou um líquido para um sólido.vale a pena destacar dois pontos-chave. Primeiro, no ponto de fusão ou ponto de ebulição de uma substância, duas fases podem existir simultaneamente. Tome como exemplo a água (H2O). Na escala Celsius, H2O tem um ponto de fusão de 0°C e um ponto de ebulição de 100°C. A 0°C, ambas as fases sólida e líquida de H2O podem coexistir. No entanto, se o calor for adicionado, parte do H2o sólido irá derreter e se transformar em H2o líquido. Se o calor for removido, o oposto acontece: alguma da H2O líquida transforma-se em H2o sólido. pode ocorrer um processo semelhante a 100°C: a adição de calor aumenta a quantidade de H2O gasoso, enquanto a remoção de calor aumenta a quantidade de H2o líquido (figura \(\PageIndex{1}\)).
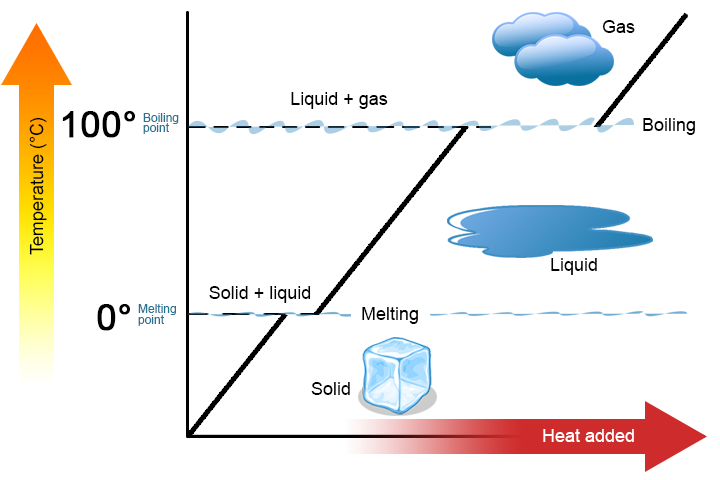
a água é uma boa substância a ser usada como exemplo porque muitas pessoas já estão familiarizadas com ela. Outras substâncias têm pontos de fusão e pontos de ebulição também.
segundo, como mostrado na figura \(\PageIndex{1}\), a temperatura de uma substância não se altera à medida que a substância passa de uma fase para outra. Em outras palavras, as mudanças de fase são isotérmicas (isotérmico significa “temperatura constante”). Novamente, considere H2O como um exemplo. A Água Sólida (gelo) pode existir a 0°C. Se o calor é adicionado ao gelo a 0°C, algumas das fases de mudanças sólidas para fazer líquido, que também está a 0°C. Lembre-se, as fases sólida e líquida de H2O podem coexistir a 0°C. só depois de todo o sólido ter derretido em líquido é que a adição de calor muda a temperatura da substância.
para cada mudança de fase de uma substância, existe uma quantidade característica de calor necessária para realizar a mudança de fase por grama (ou por mol) de material. O calor de fusão (ΔHfus) é a quantidade de calor por grama (ou por mol) necessária para uma mudança de fase que ocorre no ponto de fusão. O calor de vaporização (ΔHvap) é a quantidade de calor por grama (ou por mol) necessária para uma mudança de fase que ocorre no ponto de ebulição. Se você souber o número total de gramas ou moles de material, você pode usar o ΔHfus ou o ΔHvap para determinar o total de calor transferido por fusão ou de solidificação usando estas expressões:
\
onde \(n\) é o número de moles e \(ΔH_{fus}\) é expresso em energia/mole ou
\
onde \(m\) é a massa em gramas e \(ΔH_{fus}\) é expresso em energia por grama.
para ebulição ou condensação, utilizar estas expressões:
\
onde \(n\) é o número de moles) e \(ΔH_{vap}\) é expresso em energia/mole ou
\
onde \(m\) é a massa em gramas e \(ΔH_{vap}\) é expresso em energia por grama.
lembre-se que uma mudança de fase depende da direção da transferência de calor. Se o calor se transfere, os sólidos tornam-se líquidos, e os líquidos tornam-se sólidos nos pontos de fusão e de ebulição, respectivamente. Se o calor se transfere, os líquidos solidificam-se e os gases condensam-se em líquidos. Nesses pontos, não há mudanças de temperatura refletidas nas equações acima.
able \(\PageIndex{1}\) lists the heats of fusion and vaporization for some common substances. Observe as unidades nessas quantidades; quando você usa esses valores na resolução de problemas, certifique-se de que as outras variáveis em seu cálculo são expressas em unidades consistentes com as unidades nos aquecimentos específicos ou nos aquecimentos de fusão e vaporização.
sublimação
Há também uma mudança de fase em que um sólido vai diretamente para um gás:
\
Esta mudança de fase é chamada de sublimação. Cada substância tem um calor característico de sublimação associado a este processo. Por exemplo, o calor da sublimação (ΔHsub) de H2O é 620 cal/G.
encontramos sublimação de várias maneiras. Você pode já estar familiarizado com o gelo seco, que é simplesmente dióxido de carbono sólido (CO2). Em -78.5°C (-109°F), dióxido de carbono sólido sublimes, alterando diretamente da fase sólida para a fase gasosa:
\
dióxido de carbono Sólido é chamado de gelo seco porque não passar pela fase líquida. Em vez disso, ele faz diretamente para a fase de gás. (O dióxido de carbono pode existir como líquido, mas apenas sob alta pressão. O gelo seco tem muitos usos práticos, incluindo a preservação a longo prazo de amostras médicas.mesmo a temperaturas inferiores a 0°C, A H2O sólida irá sublimar-se lentamente. Por exemplo, uma camada fina de neve ou geada no solo pode desaparecer lentamente como o sólido H2o sublima, mesmo que a temperatura exterior pode estar abaixo do ponto de congelamento da água. Da mesma forma, cubos de gelo em um congelador podem ficar menores com o tempo. Embora congelada, a Água Sólida lentamente sublima, recolocando sobre os elementos de resfriamento mais frios do congelador, o que exige descongelação periódica (congeladores sem gelo minimizam esta recolocação). Baixar a temperatura em um freezer irá reduzir a necessidade de descongelar tão frequentemente.em circunstâncias semelhantes, a água também será sublimada a partir de alimentos congelados (por exemplo, carnes ou vegetais), dando-lhes uma aparência pouco atraente e manchada chamada queimadura de congelador. Não é realmente uma “queimadura”, e a comida não foi necessariamente ruim, embora pareça pouco apetitoso. Queimadura de congelação pode ser minimizada baixando a temperatura de um congelador e embrulhando alimentos firmemente para que a água não tenha nenhum espaço para sublimar.os exercícios de revisão de conceitos explicam o que acontece quando o calor entra ou sai de uma substância no seu ponto de fusão ou de ebulição.como é que a quantidade de calor necessária para uma mudança de fase se relaciona com a massa da substância?qual é a direcção da transferência de calor em água a ferver?qual é a direcção da transferência de calor na água gelada?Qual é a direcção da transferência de calor na transpiração?
Respostas
1. A energia vai mudar a fase, não a temperatura.
2. A quantidade de calor é uma constante por grama de substância.
3. Ebulicao. O calor está sendo adicionado à água para obtê-lo do estado líquido para o estado do gás.
4. Congelamento. O calor está a sair do sistema para passar de líquido para sólido. Outra maneira de olhar para ele é considerar o processo oposto de fusão. A energia é consumida (endotérmica) para derreter gelo (sólido a líquido) de modo que o processo oposto (líquido A sólido) deve ser exotérmico.
5. Transpiracao. O calor é consumido para evaporar a umidade em sua pele que diminui a sua temperatura.
Key Takeaway
- existe uma mudança de energia associada a qualquer mudança de fase.exercicios, quanta energia é necessária para derreter 43,8 g de UA no seu ponto de fusão de 1,064°c?
quanta energia é libertada quando 563.8 g de NaCl solidifica no seu ponto de congelação de 801°c?que massa de gelo pode ser derretida por 558 cal de energia?
Quanta etanol (C2H5OH) em gramas pode congelar no seu ponto de congelação se forem removidas 1,225 cal de calor?
Qual é o calor de vaporização de uma substância se 10.776 cal são necessários para vaporizar 5.05 g? Expressa a tua resposta final em joules por grama.
Se 1,650 cal de calor necessária para vaporizar uma amostra que tem um calor de vaporização de 137 cal/g, qual é a massa da amostra?Qual é o calor de fusão da água em calorias por mol?
Qual é o calor de vaporização do benzeno (C6H6) em calorias por mol?
Qual é o calor da vaporização do ouro em calorias por mole?Qual é o calor da fusão do ferro em calorias por mol?
Respostas
-
670 cal
3. 6, 98 g
4. 27.10 g
-
8,930 J/g
-
1,440 cal/mol
9. 80,600 cal/mol
10. 3,530 cal / mol
Leave a Reply