7.3: faseveranderingen
leerdoelstellingen
- Bepaal de warmte geassocieerd met een faseverandering.
materie kan bestaan in een van verschillende toestanden, waaronder een gas -, vloeistof-of vaste toestand. De hoeveelheid energie in moleculen van materie bepaalt de toestand van de materie.
- een gas is een toestand van materie waarin atomen of moleculen voldoende energie hebben om vrij te bewegen. De moleculen komen alleen met elkaar in contact als ze willekeurig botsen.
- een vloeistof is een toestand van materie waarin atomen of moleculen constant in contact zijn, maar genoeg energie hebben om van positie ten opzichte van elkaar te blijven veranderen.
- een vaste stof is een toestand van materie waarin atomen of moleculen niet genoeg energie hebben om te bewegen. Ze zijn voortdurend in contact en in vaste posities ten opzichte van elkaar.
Dit zijn de statuswijzigingen:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- als aan een stof warmte wordt toegevoegd, zoals bij smelten, verdampen en sublimeren, is het proces endotherm. In dit geval verhoogt warmte De snelheid van de moleculen waardoor ze sneller bewegen (voorbeelden: vast naar vloeistof; vloeistof naar gas; vast naar gas).
- indien warmte uit een stof wordt verwijderd, bijvoorbeeld bij bevriezing en condensatie, is het proces exotherm. In dit geval vermindert warmte De snelheid van de moleculen waardoor ze langzamer bewegen (voorbeelden: vloeistof naar vaste stof; gas naar vloeistof). Deze veranderingen geven warmte af aan de omgeving.
- de hoeveelheid warmte die nodig is om een monster van vast naar vloeibaar te veranderen, zou dezelfde zijn om van vloeibaar naar vast om te keren. Het enige verschil is de richting van de warmteoverdracht.
voorbeeld \(\Paginindex{1}\)
Label elk van de volgende processen als endotherm of exotherm.
- waterkokend
- ijsvorming op een vijver
oplossing
- endotherm – u moet een pan met water op het fornuis zetten en het verwarmen om water aan de kook te krijgen. Omdat je warmte/energie toevoegt, is de reactie endotherm.
- exotherm-denk in plaats daarvan aan ijsvorming in uw vriezer. Je doet water in de vriezer, die warmte uit het water haalt, om het te laten bevriezen. Omdat er warmte uit het water wordt getrokken, is het exotherm. De hitte gaat weg.
oefening \(\Paginindex{1}\)
Label elk van de volgende processen als endotherm of exotherm.
- waterdampcondensatie
- goudsmelting
antwoord
a. exotherm
b. endotherme
een faseverandering is een fysisch proces waarbij een stof van de ene fase naar de andere gaat. Gewoonlijk treedt de verandering op bij het toevoegen of verwijderen van warmte bij een bepaalde temperatuur, bekend als het smeltpunt of het kookpunt van de stof. Het smeltpunt is de temperatuur waarbij de stof van een vaste stof naar een vloeistof (of van een vloeistof naar een vaste stof) gaat. Het kookpunt is de temperatuur waarbij een stof van een vloeistof naar een gas (of van een gas naar een vloeistof) gaat. De aard van de faseverandering hangt af van de richting van de warmteoverdracht. Warmte gaat in een stof verandert het van een vaste stof in een vloeistof of een vloeistof in een gas. Het verwijderen van warmte uit een stof verandert een gas in een vloeistof of een vloeistof in een vaste stof.
twee belangrijke punten zijn het vermelden waard. Ten eerste kunnen bij het smeltpunt of kookpunt van een stof twee fasen tegelijkertijd bestaan. Neem water (H2O) als voorbeeld. Op de Celsius schaal heeft H2O een smeltpunt van 0°C en een kookpunt van 100 ° C. Bij 0°C kunnen zowel de vaste als de vloeibare fase van H2O naast elkaar bestaan. Echter, als warmte wordt toegevoegd, zal een deel van de vaste H2o smelten en veranderen in vloeibaar H2O. Als warmte wordt verwijderd gebeurt het tegenovergestelde: een deel van de vloeibare H2o verandert in vaste H2o. een vergelijkbaar proces kan plaatsvinden bij 100°C: warmte toevoegen verhoogt de hoeveelheid gasvormige H2O, terwijl warmte verwijderen de hoeveelheid vloeibare H2o verhoogt (figuur \(\Paginindex{1}\)).
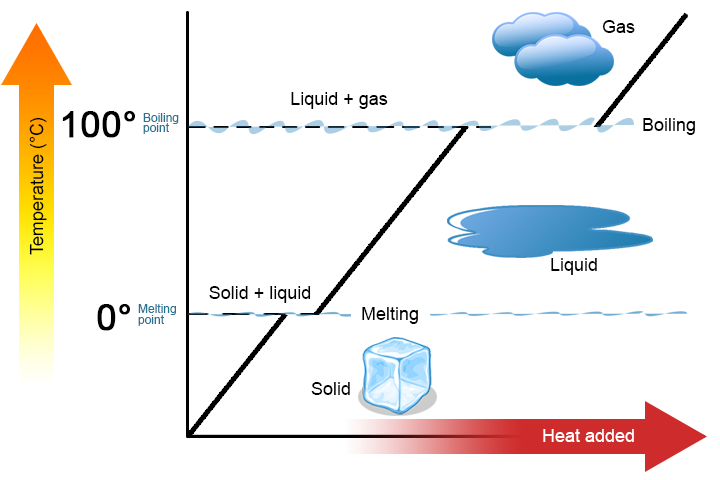
Water is een goede stof om als voorbeeld te gebruiken omdat veel mensen er al mee bekend zijn. Andere stoffen hebben ook smelt – en kookpunten.
ten tweede, zoals weergegeven in Figuur \(\Pagindex{1}\), verandert de temperatuur van een stof niet naarmate de stof van de ene fase naar de andere gaat. Met andere woorden, faseveranderingen zijn Isotherm (Isotherm betekent “constante temperatuur”). Nogmaals, beschouw H2O als een voorbeeld. Vast water (ijs) kan bestaan bij 0°C. Als warmte wordt toegevoegd aan ijs bij 0°C, sommige van de vaste veranderingen fase om vloeistof te maken, die ook bij 0°C. Vergeet niet, de vaste en vloeibare fasen van H2O kunnen naast elkaar bestaan bij 0°C. pas nadat alle vaste stof is gesmolten in vloeistof verandert de toevoeging van warmte de temperatuur van de stof.
voor elke faseverandering van een stof is er een karakteristieke hoeveelheid warmte nodig om de faseverandering per gram (of per mol) materiaal uit te voeren. De fusiewarmte (ΔHfus) is de hoeveelheid warmte per gram (of per mol) die nodig is voor een faseverandering die optreedt bij het smeltpunt. De verdampingswarmte (ΔHvap) is de hoeveelheid warmte per gram (of per mol) die nodig is voor een faseverandering die optreedt bij het kookpunt. Als u het totale aantal gram of mol materiaal kent, kunt u de ΔHfus of de ΔHvap gebruiken om de totale warmte te bepalen die wordt overgedragen voor smelten of stollen met behulp van deze uitdrukkingen:
\
waarbij \(n\) het aantal mol is en \(ΔH_{fus}\) wordt uitgedrukt in energie/mol of
\
waarbij \(m\) de massa in gram is en \(ΔH_{fus}\) wordt uitgedrukt in energie/gram.
gebruik voor het koken of condenseren deze uitdrukkingen:
\
waarin \(n\) het aantal mol is) en \(ΔH_{vap}\) wordt uitgedrukt in energie/mol of
\
waarin \(m\) de massa in gram is en \(ΔH_{vap}\) wordt uitgedrukt in energie / gram.
onthoud dat een faseverandering afhankelijk is van de richting van de warmteoverdracht. Bij warmteoverdracht worden vaste stoffen vloeibaar, en vloeistoffen worden vaste stoffen bij respectievelijk het smelt-en kookpunt. Als warmte overdracht, vloeistoffen stollen, en gassen condenseren in vloeistoffen. Op deze punten zijn er geen veranderingen in temperatuur zoals weergegeven in de bovenstaande vergelijkingen.
tabel \(\Pagindex{1}\) geeft een overzicht van de warmte van fusie en verdamping voor sommige veel voorkomende stoffen. Let op de eenheden op deze hoeveelheden; wanneer u deze waarden gebruikt bij het oplossen van problemen, zorg er dan voor dat de andere variabelen in uw berekening worden uitgedrukt in eenheden die overeenkomen met de eenheden in de specifieke heats of de heats van fusie en verdamping.
Sublimatie
Er is ook een faseverandering waarbij een vaste stof direct naar een gas gaat:
\
Deze faseverandering wordt sublimatie genoemd. Elke stof heeft een kenmerkende sublimatiewarmte die met dit proces gepaard gaat. Bijvoorbeeld, de warmte van sublimatie (ΔHsub) van H2O is 620 cal/g.
we ondervinden Sublimatie op verschillende manieren. Je bent misschien al bekend met droogijs, dat is gewoon vast kooldioxide (CO2). Bij -78,5°C (-109°F) sublimeert vast koolstofdioxide, dat direct van de vaste fase overgaat in de gasfase:
\
vast koolstofdioxide wordt droogijs genoemd omdat het niet door de vloeibare fase gaat. In plaats daarvan doet het direct aan de gasfase. (Kooldioxide kan bestaan als vloeistof, maar alleen onder hoge druk. Droogijs heeft vele praktische toepassingen, waaronder het langdurig bewaren van medische monsters.
zelfs bij temperaturen onder 0°C zal vaste H2O langzaam sublimeren. Bijvoorbeeld, een dunne laag sneeuw of vorst op de grond kan langzaam verdwijnen als de vaste H2O sublimeert, hoewel de buitentemperatuur onder het vriespunt van water kan zijn. Ook ijsblokjes in een vriezer kunnen na verloop van tijd kleiner worden. Hoewel bevroren, sublimeert het vaste water langzaam en herpositeert het op de koudere koelelementen van de vriezer, wat periodieke ontdooiing noodzakelijk maakt (vorstvrije vriezers minimaliseren deze herpositie). Het verlagen van de temperatuur in een vriezer vermindert de noodzaak om zo vaak te ontdooien.
onder soortgelijke omstandigheden zal water ook sublimeren uit diepvriesproducten (bijvoorbeeld vlees of groenten), waardoor ze een onaantrekkelijk, vlekkerig uiterlijk krijgen, genaamd vriesbrand. Het is niet echt een “brandwond” en het eten is niet per se slecht gegaan, hoewel het er niet smakelijk uitziet. Het verbranden van diepvriezers kan worden geminimaliseerd door de temperatuur van een diepvriezer te verlagen en door voedsel strak te verpakken zodat water geen ruimte heeft om in te sublimeren.
Concept Review oefeningen
- leg uit wat er gebeurt wanneer warmte stroomt in of uit een stof op het smelt-of kookpunt.
- Hoe verhoudt de hoeveelheid warmte die nodig is voor een faseverandering zich tot de massa van de stof?
- Wat is de richting van de warmteoverdracht in kokend water?
- Wat is de richting van de warmteoverdracht in vriezend water?
- Wat is de richting van warmteoverdracht bij zweten?
antwoorden
1. De energie gaat naar het veranderen van de fase, niet de temperatuur.
2. De hoeveelheid warmte is een constante per gram stof.
3. Kokend. Er wordt warmte aan het water toegevoegd om het van de vloeibare toestand naar de gastoestand te krijgen.
4. Bevriezing. Warmte verlaat het systeem om van vloeibaar naar vast te gaan. Een andere manier om ernaar te kijken is om het tegenovergestelde proces van smelten te overwegen. Er wordt energie verbruikt (endotherm) om ijs (vast naar vloeibaar) te smelten, dus het tegenovergestelde proces (vloeibaar naar vast) moet exotherm zijn.
5. Zweet. Warmte wordt verbruikt om het vocht op uw huid te verdampen, wat uw temperatuur verlaagt.
Key Takeaway
- Er is een energieverandering geassocieerd met elke faseverandering.
oefeningen
-
hoeveel energie is nodig om 43,8 g ae bij een smeltpunt van 1,064°C te smelten?
-
hoeveel energie wordt afgegeven wanneer 563.8 g NaCl stolt bij het vriespunt van 801°C?
-
welke massa ijs kan worden gesmolten met 558 cal energie?
-
hoeveel ethanol (C2H5OH) in gram kan bevriezen op het vriespunt als 1.225 cal warmte wordt verwijderd?
-
Wat is de verdampingswarmte van een stof als er 10.776 cal nodig zijn om 5,05 g te verdampen? Druk uw definitieve antwoord in joules per gram uit.
-
als er 1.650 cal warmte nodig is om een monster met een verdampingswarmte van 137 cal/g te verdampen, wat is de massa van het monster?
-
Wat is de warmte van de fusie van water in calorieën per mol?
-
Wat is de verdampingswarmte van benzeen (C6H6) in calorieën per mol?
-
Wat is de warmte van verdamping van goud in calorieën per mol?
-
Wat is de warmte van de fusie van ijzer in calorieën per mol?
antwoorden
-
670 cal
3. 6.98 g
4. 27.10 g
-
8,930 J/g
-
1.440 cal / mol
9. 80.600 cal / mol
10. 3,530 cal / mol
Leave a Reply