7.3: faseændringer
læringsmål
- Bestem varmen forbundet med en faseændring.
stof kan eksistere i en af flere forskellige tilstande, herunder en gas, flydende eller fast tilstand. Mængden af energi i molekyler af stof bestemmer stoffets tilstand.
- en gas er en tilstand af stof, hvor atomer eller molekyler har nok energi til at bevæge sig frit. Molekylerne kommer kun i kontakt med hinanden, når de tilfældigt kolliderer.
- en væske er en tilstand af stof, hvor atomer eller molekyler konstant er i kontakt, men har nok energi til at holde skiftende positioner i forhold til hinanden.
- et fast stof er en tilstand af stof, hvor atomer eller molekyler ikke har nok energi til at bevæge sig. De er konstant i kontakt og i faste positioner i forhold til hinanden.
følgende er statens ændringer:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- hvis der tilsættes varme til et stof, såsom ved smeltning, fordampning og sublimering, er processen endoterm. I dette tilfælde øger varmen molekylernes hastighed, hvilket får dem til at bevæge sig hurtigere (eksempler: fast til væske; væske til gas; fast til gas).
- hvis varme fjernes fra et stof, såsom ved frysning og kondens, er processen eksoterm. I dette tilfælde reducerer varmen molekylernes hastighed, hvilket får dem til at bevæge sig langsommere (eksempler: væske til fast stof; gas til væske). Disse ændringer frigiver varme til omgivelserne.
- den mængde varme, der er nødvendig for at ændre en prøve fra fast til væske, ville være den samme for at vende fra væske til fast stof. Den eneste forskel er retningen af varmeoverførsel.
eksempel \(\Sideindeks{1}\)
Mærk hver af følgende processer som endoterm eller eksoterm.
- vandkogende
- isdannelse på en dam
opløsning
- endotermisk – du skal sætte en pande vand på komfuret og give det varme for at få vand til at koge. Fordi du tilføjer varme/energi, er reaktionen endoterm.
- eksoterm-tænk på isdannelse i din fryser i stedet. Du lægger vand i fryseren, som tager varme ud af vandet for at få det til at fryse. Fordi varmen trækkes ud af vandet, er den eksoterm. Varmen forlader.
øvelse \(\Sideindeks{1}\)
Mærk hver af følgende processer som endoterm eller eksoterm.
- vanddamp kondenserende
- guldsmeltning
svar
a. eksoterm
b. endoterm
en faseændring er en fysisk proces, hvor et stof går fra en fase til en anden. Normalt sker ændringen, når der tilsættes eller fjernes varme ved en bestemt temperatur, kendt som smeltepunktet eller kogepunktet for stoffet. Smeltepunktet er den temperatur, hvor stoffet går fra et fast stof til en væske (eller fra en væske til et fast stof). Kogepunktet er den temperatur, hvor et stof går fra en væske til en gas (eller fra en gas til en væske). Faseændringens art afhænger af varmeoverførselsretningen. Varme, der går ind i et stof, ændrer det fra et fast stof til en væske eller en væske til en gas. Fjernelse af varme fra et stof ændrer en gas til en væske eller en væske til et fast stof.
to nøglepunkter er værd at understrege. For det første kan der ved et stofs smeltepunkt eller kogepunkt eksistere to faser samtidigt. Tag vand (H2O) som et eksempel. På Celsius-skalaen har H2O et smeltepunkt på 0 liter C og et kogepunkt på 100 liter C. Ved 0 liter C kan både de faste og flydende faser af H2O eksistere sammen. Men hvis der tilsættes varme, smelter noget af det faste H2O og bliver til flydende H2O. Hvis varmen fjernes, sker det modsatte: noget af væsken H2O bliver til fast H2O.en lignende proces kan forekomme ved 100 liter C: tilsætning af varme Øger mængden af gasformig H2O, mens fjernelse af varme Øger mængden af væske H2O (figur \(\Sideindeks{1}\)).
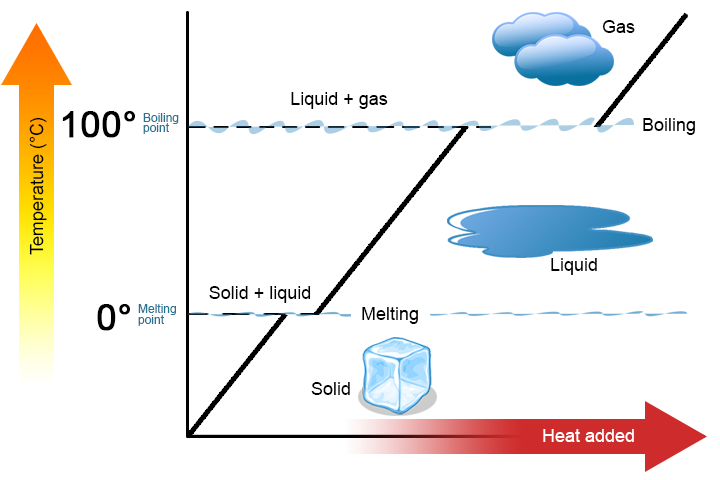
vand er et godt stof at bruge som et eksempel, fordi mange mennesker allerede er bekendt med det. Andre stoffer har også smeltepunkter og kogepunkter.
for det andet, som vist i figur \(\Sideindeks{1}\), ændres temperaturen på et stof ikke, da stoffet går fra en fase til en anden. Med andre ord er faseændringer isotermiske (isotermiske betyder “konstant temperatur”). Overvej igen H2O som et eksempel. Fast vand (is) kan eksistere ved 0 liter C. Hvis der tilsættes varme til is ved 0 liter C, ændrer noget af det faste stof fase for at fremstille væske, hvilket også er ved 0 liter C. Husk, at de faste og flydende faser af H2O kan eksistere sammen ved 0 liter C. først efter at alt det faste stof er smeltet til væske, ændrer tilsætningen af varme stoffets temperatur.
for hver faseændring af et stof er der en karakteristisk mængde varme, der er nødvendig for at udføre faseændringen pr. Fusionsvarmen (Larghfus) er den mængde varme pr.gram (eller pr. mol), der kræves til en faseændring, der opstår ved smeltepunktet. Fordampningsvarmen (Larhvap) er den mængde varme pr.gram (eller pr. mol), der kræves til en faseændring, der opstår ved kogepunktet. Hvis du kender det samlede antal gram eller mol af materiale, kan du bruge Larghfus eller Larghvap til at bestemme den samlede varme, der overføres til smeltning eller størkning ved hjælp af disse udtryk:
\
hvor \(n\) er antallet af mol og \(LARGH_{fus}\) udtrykkes i energi/mol eller
\
hvor \(m\) er massen i gram og \(LARGH_{fus}\) udtrykkes i energi/mol eller
\
hvor \ (M\) er massen i gram og \ (LARH_ {fus}\) udtrykkes i energi / gram.
til kogning eller kondensering skal du bruge disse udtryk:
\
hvor \(n\) er antallet af mol) og \(LYSH_{vap}\) udtrykkes i energi/mol eller
\
hvor \(m\) er massen i gram og \(LYSH_{vap}\) udtrykkes i energi/gram.
Husk, at en faseændring afhænger af varmeoverførselsretningen. Hvis varmeoverførsler ind, bliver faste stoffer væsker, og væsker bliver faste stoffer ved henholdsvis smelte-og kogepunkterne. Hvis varme overføres ud, størkner væsker, og gasser kondenserer til væsker. På disse punkter er der ingen ændringer i temperatur som afspejlet i ovenstående ligninger.
tabel \(\Sideindeks{1}\) viser heats af fusion og fordampning for nogle almindelige stoffer. Bemærk enhederne på disse mængder; når du bruger disse værdier i problemløsning, skal du sørge for, at de andre variabler i din beregning udtrykkes i enheder, der er i overensstemmelse med enhederne i de specifikke heats eller heats of fusion og fordampning.
sublimering
der er også en faseændring, hvor et fast stof går direkte til en gas:
\
denne faseændring kaldes sublimering. Hvert stof har en karakteristisk sublimeringsvarme forbundet med denne proces. For eksempel er sublimeringsvarmen (Lhsub) af H2O 620 cal/g.
vi støder på sublimering på flere måder. Du er måske allerede bekendt med tøris, som simpelthen er fast kulsyre (CO2). Ved -78,5 liter C (-109 liter F) sublimerer fast kulsyre, der skifter direkte fra fast fase til gasfase:
\
fast kulsyre kaldes tøris, fordi den ikke passerer gennem væskefasen. I stedet gør det direkte til gasfasen. (Kulsyre kan eksistere som væske, men kun under højt tryk.) Tøris har mange praktiske anvendelser, herunder langvarig konservering af medicinske prøver.
selv ved temperaturer under 0 liter C vil fast H2O langsomt sublime. For eksempel kan et tyndt lag sne eller frost på jorden langsomt forsvinde, når den faste H2O sublimerer, selvom udetemperaturen kan være under vandets frysepunkt. Tilsvarende kan isterninger i en fryser blive mindre over tid. Selvom det er frossent, sublimerer det faste vand langsomt og deponerer på fryserens koldere køleelementer, hvilket nødvendiggør periodisk afrimning (frostfrie frysere minimerer denne omplacering). Sænkning af temperaturen i en fryser reducerer behovet for at afrimme så ofte.
under lignende omstændigheder vil vand også sublime fra frosne fødevarer (f.eks. kød eller grøntsager), hvilket giver dem et uattraktivt, flettet udseende kaldet frysebrænding. Det er ikke rigtig en” forbrænding”, og maden er ikke nødvendigvis gået dårligt, selvom den ser uappetitlig ud. Frysebrænding kan minimeres ved at sænke fryserens temperatur og ved at indpakke fødevarer tæt, så vand ikke har plads til at sublime ind.
Konceptgennemgangsøvelser
- forklar, hvad der sker, når varme strømmer ind i eller ud af et stof ved dets smeltepunkt eller kogepunkt.
- hvordan vedrører mængden af varme, der kræves til en faseændring, stoffets masse?
- hvad er retningen for varmeoverførsel i kogende vand?
- hvad er retningen for varmeoverførsel i frysende vand?
- hvad er retningen af varmeoverførsel i sveden?
svar
1. Energien går i at ændre fasen, ikke temperaturen.
2. Mængden af varme er en konstant pr.
3. Kogende. Der tilsættes varme til vandet for at få det fra flydende tilstand til gastilstand.
4. Indefrysning. Varme forlader systemet for at gå fra væske til fast stof. En anden måde at se på det er at overveje den modsatte smelteproces. Energi forbruges (endoterm) for at smelte is (fast til flydende), så den modsatte proces (flydende til fast) skal være eksoterm.
5. Svedtendens. Varme forbruges for at fordampe fugtigheden på din hud, hvilket sænker din temperatur.
Nøgleudtag
- Der er en energiændring forbundet med enhver faseændring.
øvelser
-
hvor meget energi er der brug for til at smelte 43,8 g Au ved dets smeltepunkt på 1.064 liter C?
-
hvor meget energi afgives, når 563.8 g NaCl størkner ved dets frysepunkt på 801 liter C?
-
hvilken ismasse kan smeltes med 558 Cal energi?
-
hvor meget ethanol (C2H5OH) i gram kan fryse ved frysepunktet, hvis 1.225 cal varme fjernes?
-
Hvad er fordampningsvarmen for et stof, hvis der kræves 10.776 cal for at fordampe 5,05 g? Udtryk dit endelige svar i joules pr.
-
Hvis der kræves 1.650 cal varme for at fordampe en prøve, der har en fordampningsvarme på 137 cal/g, hvad er massen af prøven?
-
Hvad er varmen af fusion af vand i kalorier pr. mol?
-
Hvad er fordampningsvarmen af bensene (C6H6) i kalorier pr. mol?
-
Hvad er fordampningsvarmen af guld i kalorier pr. mol?
-
Hvad er varmen af fusion af jern i kalorier pr. mol?
svar
-
670 cal
3. 6, 98 g
4. 27, 10 g
-
8.930 J/g
-
1.440 cal/mol
9. 80.600 cal/mol
10. 3.530 cal / mol
Leave a Reply