7.3:相変化
学習目標
- 相変化に関連する熱を決定します。物質は、気体、液体、または固体状態を含むいくつかの異なる状態のいずれかで存在することができる。 物質の分子のエネルギーの量は、物質の状態を決定します。ガスは、原子や分子が自由に動くのに十分なエネルギーを持っている物質の状態です。
- ガスは、原子や分子が自由に動くのに十分なエネルギーを持 分子は、それらがランダムに衝突するときにのみ、互いに接触する。 液体は、原子または分子が常に接触しているが、互いに相対的に位置を変化させ続けるのに十分なエネルギーを有する物質の状態である。
- 液体は、 固体は、原子や分子が移動するのに十分なエネルギーを持っていない物質の状態です。
- 固体は、原子や分子が移動するのに十分なエネルギーを持ってい 彼らは常に接触しており、互いに相対的に固定された位置にあります。
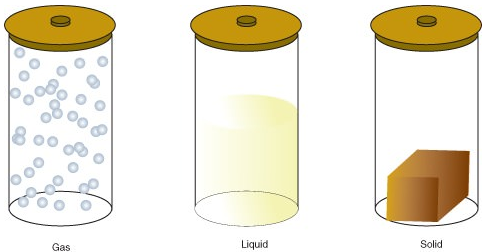
図\(\PageIndex{1}\):物質の状態。 3つの容器にはすべて同じ質量の物質が含まれていますが、物質は異なる状態にあります。 左側の容器では、物質はガスであり、その容器を満たすために広がっている。 それは容器の形そして容積を両方取ります。 中央の容器では、物質は液体であり、容器の形状をとるように広がっているが、体積は広がっていない。 右側の容器では、物質は固体であり、容器の形状も体積も取らない。figcaption> 以下は、状態の変更です:
Solid → Liquid Melting or fusion Liquid → Gas Vaporization Liquid → Solid Freezing Gas → Liquid Condensation Solid → Gas Sublimation - 溶融、気化、昇華などの物質に熱を加えると、プロセスは吸熱です。 この例では、熱は分子の速度を増加させ、分子をより速く移動させる(例:固体から液体、液体から気体、固体から気体)。
- 凍結や凝縮などの物質から熱が除去されると、プロセスは発熱します。
- i この例では、熱は分子の速度を低下させ、分子の移動が遅くなります(例:液体から固体、気体から液体)。 これらの変化は周囲に熱を放出する。
- サンプルを固体から液体に変えるのに必要な熱量は、液体から固体に逆にするのと同じです。
- サンプルを固体に変えるのに必要な熱量 唯一の違いは熱伝達の方向です。
例\(\PageIndex{1}\)
次のプロセスのそれぞれを吸熱または発熱としてラベル付けします。
- 水沸騰
- 池の上に形成する氷
ソリューション
- 吸熱-あなたはストーブの上に水の鍋を入れて、水が沸騰 あなたは熱/エネルギーを加えているので、反応は吸熱です。
- 発熱-代わりに冷凍庫で氷が形成されることを考えてください。 あなたはそれが凍結するために取得するために、水から熱を取る冷凍庫に水を入れます。 熱が水から引き出されているので、それは発熱です。 熱が残っています。
運動\(\PageIndex{1}\)
次のプロセスのそれぞれを吸熱または発熱としてラベル付けします。
- 水蒸気凝縮
- 金溶融
答え
a.発熱
b. 吸熱
相変化は、物質がある相から別の相に移動する物理的プロセスです。 通常、この変化は、物質の融点または沸点として知られる特定の温度で熱を添加または除去するときに生じる。 融点は、物質が固体から液体に(または液体から固体に)移行する温度である。 沸点は、物質が液体から気体に(または気体から液体に)移行する温度である。 相変化の性質は、熱伝達の方向に依存する。 物質に入る熱は、固体から液体、または液体から気体に変化します。 物質から熱を除去することは、気体を液体に、または液体を固体に変化させる。
二つの重要なポイントは強調する価値があります。 第一に、物質の融点または沸点において、2つの相が同時に存在することができる。 例として水(H2O)を取る。 摂氏スケールでは、H2Oは0°Cの融点および100°Cの沸点を有する0°Cでは、h2Oの固相および液相の両方が共存することができる。 しかし、熱が加えられると、固体のH2Oの一部が溶融して液体のH2Oに変わります。 同様のプロセスは、100℃で発生する可能性があります:熱を追加すると、気体のH2Oの量が増加し、熱を削除すると、液体のH2Oの量が増加します(図\(\PageIndex{1}\))。P>
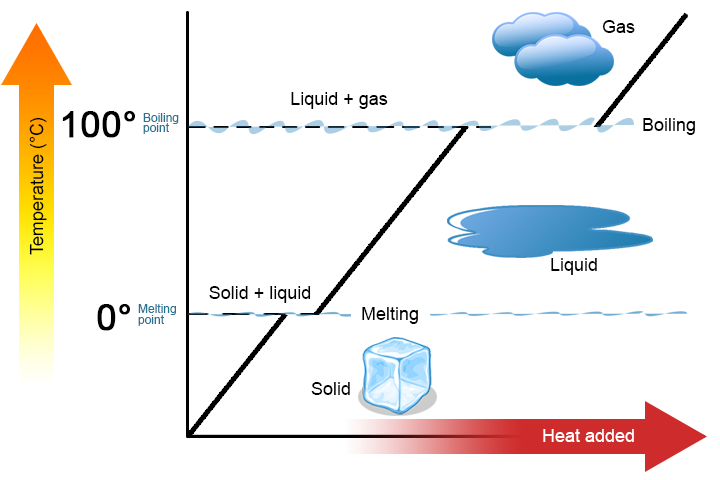
図\(\PageIndex{2}\):水の加熱曲線。 熱が固体水に加えられると、融点である0℃に達するまで温度が上昇する。 この時点で、相変化、追加された熱は、固体から液体への状態の変化に入ります。 この相変化が完了したときにのみ、温度が上昇する可能性があります。 (CC BY3.0Unported;Community College Consortium for Bioscience Credentials)。 水は、多くの人々がすでにそれに精通しているので、例として使用するのに適した物質です。 他の物質にも融点と沸点があります。第二に、図\(\PageIndex{1}\)に示すように、物質がある相から別の相に進むにつれて物質の温度は変化しません。 言い換えれば、相変化は等温である(等温は”一定温度”を意味する)。 ここでも、例としてH2Oを考えてみましょう。 固体水(氷)は0℃で存在することができます熱が0℃で氷に追加された場合、固体のいくつかは、0℃でもある液体を作るために相を変更します覚えておいてください、H2Oの固相と液相は0℃で共存することができます固体のすべてが液体に溶融した後にのみ、熱の添加は、物質の温度を変更しません。物質の相変化ごとに、物質のグラム当たり(またはモル当たり)の相変化を実行するために必要な熱の特性量があります。
物質の相変化のために、熱の特性量があります。
物質の相変化の特性量があります。 融解熱(Δ Hfus)は、融点で発生する相変化に必要なグラム当たり(またはモル当たり)の熱の量です。 蒸発熱(Δ Hvap)は、沸点で発生する相変化に必要なグラム当たり(またはモル当たり)の熱の量です。 材料のグラムまたはモル数の合計がわかっている場合は、Δ HfusまたはΔ Hvapを使用して、次の式を使用して溶融または凝固のために転送される総熱を決定することができます。
\
ここで、\(N\)はモル数であり、\(Δ H_{fus}\)はエネルギー/モルまたは
\
ここで、\(m\)はグラム単位の質量であり、\(Δ H_{fus}\)はエネルギー/モルまたは
\
ここで、\(M\)はグラム単位の質量であり、\(Δ H_{fus}\)はエネルギー/モルまたは
\
ここで、\(M\)はグラム単位の質量であり、\(Δ H_{fus}\)はエネルギー/モルまたは
エネルギー/グラムで表されます。
沸騰または凝縮の場合は、次の式を使用します:ここで、\(N\)はモル数であり、\(Δ H_{vap}\)はエネルギー/モルまたは\(m\)はグラム単位の質量であり、\(Δ H_{vap}\)はエネルギー/グラムで表されます。
相変化は熱伝達の方向に依存することを忘れないでください。 熱が移動すると、固体は液体になり、液体はそれぞれ溶融点と沸点で固体になります。 熱が外に移動すると、液体は凝固し、気体は液体に凝縮する。 これらの点では、上記の式に反映されているように温度の変化はありません。表\(\PageIndex{1}\)は、いくつかの一般的な物質の融合と気化の熱を示しています。 これらの値を問題解決に使用する場合は、計算内の他の変数が、特定の熱または融合および気化の熱の単位と一致する単位で表されることを確認し
昇華
固体がガスに直接移動する相変化もあります。
\
この相変化は昇華と呼ばれます。
この相変化は昇華と呼ばれます。
昇華
各物質は、このプロセスに関連する特徴的な昇華熱を有する。 例えば、h2Oの昇華熱(Δ Hsub)は620cal/gです。
いくつかの方法で昇華に遭遇します。 あなたはすでに単に固体二酸化炭素(CO2)であるドライアイスに精通しているかもしれません。 -78.5°c(-109°F)では、固体二酸化炭素が昇華し、固相から気相に直接変化します。
\
固体二酸化炭素は液相を通過しないため、ドライアイスと呼ばれます。 代わりに、それは気相に直接行います。 (二酸化炭素は液体として存在することができますが、高圧下でのみ存在することができます。)ドライアイスに医学のサンプルの長期保存を含む多くの実用的な使用が、あります。
0℃以下の温度でも、固体H2Oはゆっくりと崇高になります。 例えば、外気温が水の凝固点を下回っていても、固体H2Oが昇華するにつれて、地面の雪や霜の薄い層がゆっくりと消えることがあります。 同様に、冷凍庫内の氷は、時間の経過とともに小さくなることがあります。 凍結されているが、固体水はゆっくりと昇華し、定期的な除霜を必要とする冷凍庫のより冷たい冷却要素に再堆積する(霜のない冷凍庫はこの再堆積を最小化する)。 冷凍庫の温度を下げると、頻繁に解凍する必要がなくなります。
同様の状況下では、水は冷凍食品(肉や野菜など)からも崇高になり、冷凍庫の火傷と呼ばれる魅力的ではない斑点のある外観を与えます。 それは本当に”やけど”ではなく、食べ物は必ずしも悪くなっていませんが、それは食欲をそそらないように見えます。 フリーザーの焼跡はフリーザーの温度を下げることと食糧を堅く包むことによって最小にすることができる従って水に崇高にするスペースがない。
コンセプトレビュー演習
- 熱がその融点または沸点で物質に出入りするときに何が起こるかを説明します。
- 相変化に必要な熱量は物質の質量にどのように関係していますか?
- 相変化に必要な熱量は物質の質量にどのように関係しています
- 沸騰水中の熱伝達の方向は何ですか?
- 凍結水の熱伝達の方向は何ですか?
- 発汗時の熱伝達の方向は何ですか?
答え
1。 エネルギーは温度ではなく位相を変えることになります。p>
2. 熱の量は物質のグラムあたりの定数です。p>
3. 沸騰しています。 熱は液体状態からガス状態にそれを得るために水に加えられています。p>
4. 凍えています。 熱は液体から固体に行くためにシステムを出ています。 それを見るもう一つの方法は、溶融の反対のプロセスを考慮することです。 エネルギーは氷(固体から液体)を溶かすために(吸熱的に)消費されるので、反対のプロセス(液体から固体)は発熱的でなければならない。
5. 汗をかいています。 熱はあなたの温度を下げるあなたの皮の湿気を蒸発させるために消費される。
キーテイクアウト
- 任意の相変化に関連するエネルギー変化があります。
演習
-
43.8gのAuを融点1,064℃で溶かすにはどれくらいのエネルギーが必要ですか?
-
563のときにどのくらいのエネルギーが放出されますか。8gのNaClは801°Cの凝固点で凝固しますか。
-
どのような氷の質量は、エネルギーの558カルによって溶融することができますか?1,225calの熱が除去された場合、グラム単位のエタノール(C2H5OH)が凝固点で凍結することができますか?10,776calが5.05gを蒸発させるために必要とされる場合、物質の気化熱は何ですか? あなたの最終的な答えをグラムあたりジュールで表現してください。137cal/gの気化熱を持つサンプルを蒸発させるために1,650calの熱が必要な場合、サンプルの質量はいくらですか?
-
モル当たりのカロリーで水の融合の熱は何ですか?p>
-
ベンゼン(c6H6)の蒸発熱はモル当たりのカロリーで何ですか?
-
金の蒸発の熱はモル当たりのカロリーで何ですか?
-
モル当たりのカロリーで鉄の融合の熱は何ですか?
答え
-
670cal
2. 69,630cal3. 6.98g
4. 27.10g
-
8,930J/g
-
1,440cal/mol
9. 80,600cal/mol
10。 3,530cal/mol
Leave a Reply