7.3: fasförändringar
inlärningsmål
- Bestäm värmen associerad med en fasförändring.
Materia kan existera i ett av flera olika tillstånd, inklusive ett gas -, flytande eller fast tillstånd. Mängden energi i molekyler av materia bestämmer materiens tillstånd.
- en gas är ett tillstånd av materia där atomer eller molekyler har tillräckligt med energi för att röra sig fritt. Molekylerna kommer i kontakt med varandra endast när de slumpmässigt kolliderar.
- en vätska är ett tillstånd av materia där atomer eller molekyler ständigt är i kontakt men har tillräckligt med energi för att hålla förändrade positioner i förhållande till varandra.
- ett fast ämne är ett tillstånd av materia där atomer eller molekyler inte har tillräckligt med energi för att röra sig. De är ständigt i kontakt och i fasta positioner i förhållande till varandra.
Följande är tillståndsändringarna:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- Om värme tillsätts till ett ämne, såsom vid smältning, förångning och sublimering, är processen endoterm. I detta fall ökar värmen hastigheten på molekylerna som får dem att röra sig snabbare (exempel: fast till vätska; vätska till gas; fast till gas).
- Om värme avlägsnas från ett ämne, såsom vid frysning och kondensation, är processen exoterm. I detta fall minskar värmen molekylernas hastighet vilket gör att de rör sig långsammare (exempel: vätska till fast; gas till vätska). Dessa förändringar frigör värme till omgivningen.
- mängden värme som behövs för att ändra ett prov från fast till flytande skulle vara densamma för att vända från vätska till fast. Den enda skillnaden är riktningen för värmeöverföring.
exempel \(\PageIndex{1}\)
Märk var och en av följande processer som endoterm eller exoterm.
- vattenkokande
- isbildning på en damm
lösning
- endotermisk – du måste lägga en panna med vatten på spisen och ge den värme för att få vatten att koka. Eftersom du lägger till värme/energi är reaktionen endoterm.
- exoterm-tänk på isbildning i frysen istället. Du lägger vatten i frysen, som tar värme ur vattnet, för att få det att frysa. Eftersom värmen dras ut ur vattnet är den exoterm. Värmen lämnar.
övning \(\PageIndex{1}\)
Märk var och en av följande processer som endoterm eller exoterm.
- kondensering av vattenånga
- guldsmältning
svar
a. exoterm
b. endoterm
en fasförändring är en fysisk process där ett ämne går från en fas till en annan. Vanligtvis sker förändringen när man lägger till eller tar bort värme vid en viss temperatur, känd som smältpunkten eller kokpunkten för ämnet. Smältpunkten är temperaturen vid vilken ämnet går från ett fast ämne till en vätska (eller från en vätska till en fast substans). Kokpunkten är den temperatur vid vilken ett ämne går från en vätska till en gas (eller från en gas till en vätska). Fasförändringens natur beror på värmeöverföringens riktning. Värme som går in i ett ämne ändrar det från ett fast ämne till en vätska eller en vätska till en gas. Avlägsnande av värme från ett ämne ändrar en gas till en vätska eller en vätska till en fast substans.
två viktiga punkter är värda att betona. Först vid ett ämnes smältpunkt eller kokpunkt kan två faser existera samtidigt. Ta vatten (H2O) som ett exempel. På Celsius-skalan har H2O en smältpunkt på 0 C C och en kokpunkt på 100 C C. Vid 0 C C kan både de fasta och flytande faserna av H2O samexistera. Men om värme tillsätts smälter en del av den fasta H2O och förvandlas till flytande H2O. Om värme avlägsnas händer det motsatta: en del av vätskan H2O förvandlas till fast H2O. en liknande process kan inträffa vid 100 kb C: tillsats av värme ökar mängden gasformig H2O, medan avlägsnande av värme ökar mängden flytande H2O (figur \(\PageIndex{1}\)).
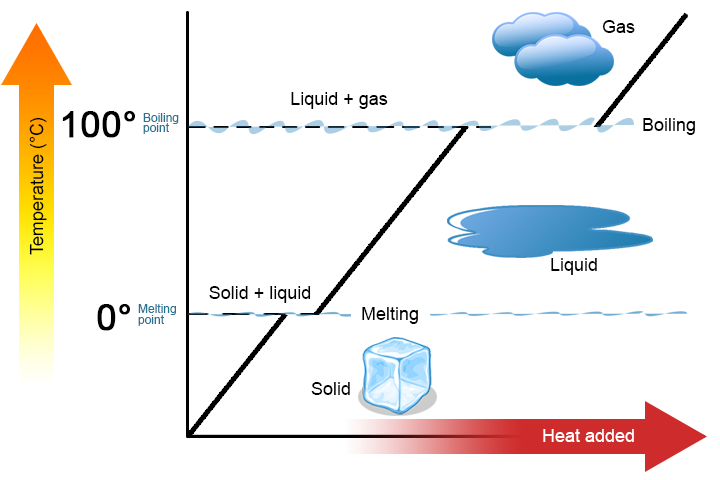
vatten är ett bra ämne att använda som exempel eftersom många redan är bekanta med det. Andra ämnen har smältpunkter och kokpunkter också.
andra, som visas i Figur \(\PageIndex{1}\), ändras inte temperaturen för ett ämne eftersom ämnet går från en fas till en annan. Med andra ord är fasförändringar isotermiska (isotermisk betyder ”konstant temperatur”). Återigen, överväga H2O som ett exempel. Fast vatten (is) kan existera vid 0 kg C. Om värme tillsätts till IS vid 0 kg C, ändrar en del av den fasta fasen för att göra vätska, vilket också är vid 0 kg C. Kom ihåg att de fasta och flytande faserna av H2O kan samexistera vid 0 kg C. Först efter att allt fast ämne har smält till vätska ändrar tillsatsen av värme ämnets temperatur.
för varje fasförändring av ett ämne finns det en karakteristisk mängd värme som behövs för att utföra fasförändringen per gram (eller per mol) material. Fusionsvärmen (Asihfus) är den mängd värme per gram (eller per mol) som krävs för en fasförändring som inträffar vid smältpunkten. Förångningsvärmen (Cihvap) är den mängd värme per gram (eller per mol) som krävs för en fasförändring som sker vid kokpunkten. Om du känner till det totala antalet gram eller mol av material, kan du använda den för att bestämma den totala värme som överförs för smältning eller stelning med hjälp av dessa uttryck:
\
där \(n\) är antalet mol och \(SICH_{fus}\) uttrycks i energi/mol eller
\
där \(m\) är massan i gram och \(SICH_{fus}\) uttrycks i energi/gram.
för kokning eller kondensation, använd dessa uttryck:
\
där \(n\) är antalet mol) och \(CIKH_{vap}\) uttrycks i energi/mol eller
\
där \(m\) är massan i gram och \(CIKH_{vap}\) uttrycks i energi/gram.
Kom ihåg att en fasförändring beror på värmeöverföringens riktning. Om värmeöverföringar i, fasta ämnen blir vätskor, och vätskor blir fasta ämnen vid smältning och kokpunkter, respektive. Om värme överförs stelnar vätskor och gaser kondenseras till vätskor. Vid dessa punkter finns inga temperaturförändringar som återspeglas i ovanstående ekvationer.
tabell \(\PageIndex{1}\) listar fusions-och förångningsvärmen för vissa vanliga ämnen. Notera enheterna på dessa kvantiteter; när du använder dessa värden i problemlösning, se till att de andra variablerna i din beräkning uttrycks i enheter som överensstämmer med enheterna i de specifika heaten eller fusions-och förångningsvärmen.
sublimering
det finns också en fasförändring där ett fast ämne går direkt till en gas:
\
denna fasförändring kallas sublimering. Varje substans har en karakteristisk sublimeringsvärme associerad med denna process. Till exempel är sublimeringsvärmen (Hihsub) av H2O 620 cal/g.
vi stöter på sublimering på flera sätt. Du kanske redan är bekant med torris, som helt enkelt är fast koldioxid (CO2). Vid -78,5 ci C (-109 ci f) sublimerar fast koldioxid, som ändras direkt från fast fas till gasfas:
\
fast koldioxid kallas torris eftersom den inte passerar genom vätskefasen. Istället gör det direkt till gasfasen. (Koldioxid kan existera som vätska men endast under högt tryck.) Torris har många praktiska användningsområden, inklusive långsiktigt bevarande av medicinska prover.
även vid temperaturer under 0 C C kommer fast H2o långsamt att sublima. Till exempel kan ett tunt lager av snö eller frost på marken långsamt försvinna när den fasta H2O sublimerar, även om utetemperaturen kan ligga under fryspunkten för vatten. På samma sätt kan isbitar i en frys bli mindre med tiden. Även om det är fruset, sublimerar det fasta vattnet långsamt, vilket ompositionerar på frysens kallare kylelement, vilket kräver periodisk avfrostning (frostfria frysar minimerar denna ompositionering). Att sänka temperaturen i en frys minskar behovet av att tina så ofta.
under liknande omständigheter kommer vatten också att sublima från frysta livsmedel (t.ex. kött eller grönsaker), vilket ger dem ett oattraktivt, fläckigt utseende som kallas frysförbränning. Det är inte riktigt en” bränna”, och maten har inte nödvändigtvis gått dåligt, även om det ser obehagligt ut. Frysbränning kan minimeras genom att sänka frysens temperatur och genom att förpacka mat tätt så att vatten inte har något utrymme att sublima in i.
Concept Review övningar
- förklara vad som händer när värme strömmar in i eller ut ur ett ämne vid dess smältpunkt eller kokpunkt.
- hur relaterar den mängd värme som krävs för en fasförändring till ämnets massa?
- vad är riktningen för värmeöverföring i kokande vatten?
- vad är riktningen för värmeöverföring i frysvatten?
- vad är riktningen för värmeöverföring vid svettning?
svar
1. Energin går in i att ändra fasen, inte temperaturen.
2. Mängden värme är en konstant per gram substans.
3. Kokande. Värme läggs till vattnet för att få det från flytande tillstånd till gastillståndet.
4. Frysning. Värme lämnar systemet för att gå från vätska till fast. Ett annat sätt att titta på det är att överväga den motsatta smältprocessen. Energi förbrukas (endoterm) för att smälta is (fast till flytande) så motsatt process (flytande till fast) måste vara exoterm.
5. Svettning. Värme förbrukas för att avdunsta fukten på huden som sänker din temperatur.
Key Takeaway
- Det finns en energiförändring associerad med någon fasförändring.
övningar
-
hur mycket energi behövs för att smälta 43,8 g Au vid dess smältpunkt på 1,064 xnumx C?
-
hur mycket energi avges när 563.8 g NaCl stelnar vid sin fryspunkt på 801 C?
-
vilken massa is kan smältas med 558 Kal energi?
-
hur mycket etanol (C2H5OH) i gram kan frysa vid fryspunkten om 1 225 Kal värme avlägsnas?
-
vad är förångningsvärmen för ett ämne om 10,776 cal krävs för att förånga 5,05 g? Uttryck ditt slutliga svar i joule per gram.
-
om 1 650 Kal värme krävs för att förånga ett prov som har en förångningsvärme på 137 Kal/g, vad är provets massa?
-
vad är värmen av fusion av vatten i kalorier per mol?
-
vad är förångningsvärmen av bensen (C6H6) i kalorier per mol?
-
vad är värmen av förångning av guld i kalorier per mol?
-
vad är värmen av fusion av järn i kalorier per mol?
svar
-
670 cal
3. 6, 98 g
4. 27,10 g
-
8,930 J/g
-
1,440 cal/mol
9. 80,600 cal / mol
10. 3,530 cal / mol
Leave a Reply