7.3: Faseendringer
Læringsmål
- Bestem varmen forbundet med en faseendring.
Materie kan eksistere i en av flere forskjellige tilstander, inkludert en gass, væske eller fast tilstand. Mengden energi i molekyler av materie bestemmer tilstanden av materie.en gass er en tilstand av materie der atomer eller molekyler har nok energi til å bevege seg fritt. Molekylene kommer bare i kontakt med hverandre når de tilfeldigvis kolliderer. en væske er en tilstand av materie der atomer eller molekyler er konstant i kontakt, men har nok energi til å holde skiftende posisjoner i forhold til hverandre. et fast stoff er en tilstand av materie der atomer eller molekyler ikke har nok energi til å bevege seg. De er stadig i kontakt og i faste stillinger i forhold til hverandre.
følgende er tilstandsendringer:
| Solid → Liquid | Melting or fusion |
| Liquid → Gas | Vaporization |
| Liquid → Solid | Freezing |
| Gas → Liquid | Condensation |
| Solid → Gas | Sublimation |
- hvis varme tilsettes til et stoff, som ved smelting, fordampning og sublimering, er prosessen endoterm. I dette tilfellet øker varmen hastigheten på molekylene som får dem til å bevege seg raskere(eksempler: fast til væske; væske til gass; solid til gass).
- hvis varme fjernes fra et stoff, som ved frysing og kondensering, er prosessen eksoterm. I dette tilfellet reduserer varmen hastigheten til molekylene som får dem til å bevege seg langsommere(eksempler: væske til fast stoff; gass til væske). Disse endringene frigjør varme til omgivelsene.
- mengden varme som trengs for å endre en prøve fra fast til væske, vil være den samme for å reversere fra væske til fast stoff. Den eneste forskjellen er retningen for varmeoverføring.
Eksempel \(\PageIndex{1}\)
Merk hver av følgende prosesser som endoterm eller eksoterm.
- vannkoking
- isdannelse på en dam
Løsning
- endoterm – du må sette en kjele med vann på komfyren og gi den varme for å få vann til å koke. Fordi du legger til varme/energi, er reaksjonen endoterm.
- exothermic-tenk på isdannelse i fryseren i stedet. Du legger vann i fryseren, som tar varme ut av vannet, for å få det til å fryse. Fordi varmen blir trukket ut av vannet, er det eksoterm. Varmen forsvinner.
Øvelse \(\PageIndex{1}\)
Merk hver av følgende prosesser som endoterm eller eksoterm.
- kondenserende vanndamp
- gullsmelting
Svar
eksoterm
b. endoterm
en faseendring er en fysisk prosess der et stoff går fra en fase til en annen. Vanligvis skjer endringen når du legger til eller fjerner varme ved en bestemt temperatur, kjent som smeltepunktet eller kokepunktet til stoffet. Smeltepunktet er temperaturen der stoffet går fra et fast stoff til en væske(eller fra en væske til et fast stoff). Kokepunktet er temperaturen der et stoff går fra en væske til en gass (eller fra en gass til en væske). Naturen til faseendringen avhenger av retningen av varmeoverføringen. Varme som går inn i et stoff, endrer det fra et fast stoff til en væske eller en væske til en gass. Fjerning av varme fra et stoff endrer en gass til en væske eller en væske til et fast stoff.
To viktige punkter er verdt å understreke. For det første, ved et stoffs smeltepunkt eller kokepunkt, kan to faser eksistere samtidig. Ta vann (H2O) som et eksempel. På Celsius-skalaen har H2O et smeltepunkt på 0°C Og et kokepunkt på 100°C. Ved 0°C kan BÅDE faste og flytende faser AV H2O eksistere sammen. Men hvis varme tilsettes, vil noe av det faste H2O smelte og bli til flytende H2O. Hvis varmen fjernes, skjer det motsatte: noe av væsken H2O blir til fast H2O. en lignende prosess kan oppstå ved 100°C: tilsetning av varme øker mengden gassformig H2O, mens fjerning av varme øker mengden væske H2O(Figur \(\PageIndex{1}\)).
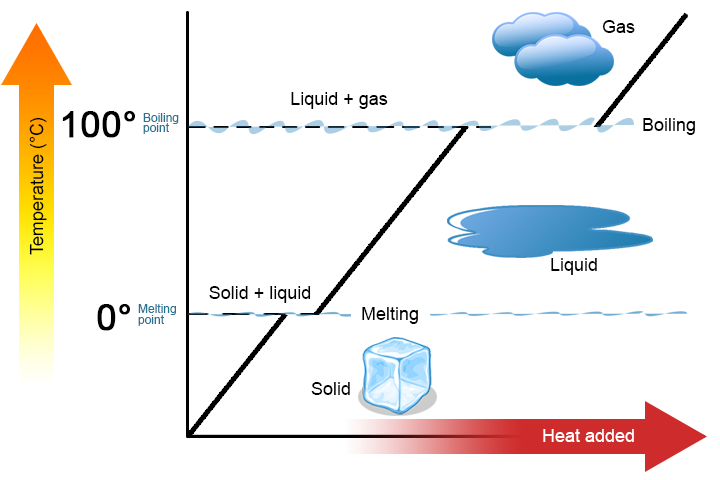
Vann Er et godt stoff å bruke som et eksempel fordi mange mennesker allerede er kjent med det. Andre stoffer har også smeltepunkter og kokepunkter.For Det Andre, som vist I Figur \(\PageIndex{1}\), endres ikke temperaturen til et stoff ettersom stoffet går fra en fase til en annen. Med andre ord er faseendringer isotermiske (isotermisk betyr «konstant temperatur»). Igjen, vurder H2O som et eksempel. Fast vann (is) kan eksistere ved 0 hryvnias C. hvis det tilsettes varme til is ved 0 hryvnias C, vil noe av det faste stoffet endre fasen for å lage væske, som også er ved 0 hryvnias C. Husk AT de faste og flytende fasene AV H2O kan sameksistere ved 0 hryvnias C. Først etter at alt det faste stoffet har smeltet til væske, endrer tilsetningen av varme stoffets temperatur.
for hver faseendring av et stoff er det en karakteristisk mengde varme som trengs for å utføre faseendringen per gram (eller per mol) materiale. Fusjonsvarmen (Δ) er mengden varme per gram (eller per mol) som kreves for en faseendring som oppstår ved smeltepunktet. Fordampningsvarmen (Δ) er mengden varme per gram (eller per mol) som kreves for en faseendring som oppstår ved kokepunktet. Hvis du vet det totale antallet gram eller mol av materiale, kan Du bruke Δ Eller Δ for å bestemme den totale varmen som overføres for smelting eller størkning ved hjelp av disse uttrykkene:
\
hvor \(N\) er antall mol og \(ΔH_{fus}\) er uttrykt i energi/mol eller
\
hvor \(m\) er massen i gram og \(ΔH_{fus}\) er uttrykt i energi/mol eller
\
hvor \ (m\) er massen i gram og \ (ΔH_ {fus}\) uttrykkes i energi / gram.
for koking eller kondensering, bruk disse uttrykkene:
\
hvor \(n\) er antall mol) og \(③H_{vap}\) er uttrykt i energi / mol eller
\
hvor \(m\) er massen i gram og \(ΔH_{vap}\) er uttrykt i energi/gram.
Husk at en faseendring avhenger av retningen av varmeoverføringen. Hvis varme overfører inn, blir faste stoffer væsker, og væsker blir faste stoffer ved henholdsvis smelte-og kokepunktene. Hvis varme overføres, størkner væsker, og gasser kondenserer til væsker. På disse punktene er det ingen endringer i temperatur som reflektert i de ovennevnte ligningene.
Tabell \(\PageIndex{1}\) viser varmen av fusjon og fordampning for noen vanlige stoffer. Merk enhetene på disse mengdene; når du bruker disse verdiene i problemløsning, sørg for at de andre variablene i beregningen er uttrykt i enheter i samsvar med enhetene i de spesifikke heats eller heats av fusjon og fordampning.
Sublimering
det er også en faseendring der et fast stoff går direkte til en gass:
\
denne faseendringen kalles sublimering. Hvert stoff har en karakteristisk sublimeringsvarme forbundet med denne prosessen. For eksempel er varmen av sublimering (Δ) AV H2O 620 cal / g.
vi møter sublimering på flere måter. Du kan allerede være kjent med tøris, som bare er fast karbondioksid (CO2). Ved -78.5°C (-109°F), fast karbondioksid sublimerer, endres direkte fra fast fase til gassfase:
\
Fast karbondioksid kalles tørris fordi Den ikke passerer gjennom væskefasen. I stedet gjør det direkte til gassfasen. (Karbondioksid kan eksistere som væske, men bare under høyt trykk.) Tørris har mange praktiske bruksområder, inkludert langvarig bevaring av medisinske prøver.
selv ved temperaturer under 0°C vil solid H2O sakte sublime. For eksempel kan et tynt lag av snø eller frost på bakken sakte forsvinne som den faste h2o sublimerer, selv om utetemperaturen kan være under frysepunktet for vann. På samme måte kan isbiter i en fryser bli mindre over tid. Selv om det er frosset, sublimerer det faste vannet sakte, redepositerer på de kaldere kjøleelementene i fryseren, noe som nødvendiggjør periodisk avriming (frostfrie frysere minimerer denne redeposisjonen). Senking av temperaturen i en fryser vil redusere behovet for å tine så ofte.under lignende omstendigheter vil vann også sublime fra frosne matvarer (f. eks. kjøtt eller grønnsaker), noe som gir dem et uattraktivt, flettet utseende som kalles frysebrenn. Det er egentlig ikke en «brenne», og maten har ikke nødvendigvis gått dårlig, selv om den ser uappetittlig ut. Fryser brenne kan minimeres ved å senke en fryser temperatur og ved å pakke mat tett så vann ikke har noen plass til sublime inn.
Concept Review Øvelser
- Forklar hva som skjer når varme strømmer inn i eller ut av et stoff ved smeltepunktet eller kokepunktet.
- Hvordan relaterer mengden varme som kreves for en faseendring til massen av stoffet?
- hva er retningen for varmeoverføring i kokende vann?
- hva er retningen for varmeoverføring i frysende vann?
- hva er retningen for varmeoverføring i svette?
Svar
1. Energien går inn i å endre fasen, ikke temperaturen.
2. Mengden varme er en konstant per gram substans.
3. Kokende. Varme blir tilsatt til vannet for å få det fra flytende tilstand til gass tilstand.
4. Iskald. Varme går ut av systemet for å gå fra væske til fast stoff. En annen måte å se på er å vurdere den motsatte smelteprosessen. Energi forbrukes (endoterm) for å smelte is (fast til væske), så den motsatte prosessen (flytende til fast) må være eksoterm.
5. Svetting. Varme forbrukes for å fordampe fuktigheten på huden din som senker temperaturen.
Key Takeaway
- det er en energiendring knyttet til enhver faseendring.
Øvelser
-
hvor mye energi trengs for å smelte 43,8 g Au ved smeltepunktet på 1 064°C?
-
hvor mye energi blir gitt av når 563.8 g NaCl stivner ved frysepunktet på 801°C?
-
hvilken masse is kan smeltes med 558 cal energi?
-
Hvor mye etanol (C2H5OH) i gram kan fryse ved frysepunktet hvis 1,225 cal varme fjernes?
-
Hva er fordampningsvarmen av et stoff hvis 10,776 cal kreves for å fordampe 5,05 g? Gi ditt endelige svar i joules per gram.
-
Hvis 1,650 cal varme kreves for å fordampe en prøve som har en fordampningsvarme på 137 cal/g, hva er massen av prøven?
-
hva er varmen av fusjon av vann i kalorier per mol?
-
hva er varmen av fordampning av benzen (C6H6) i kalorier per mol?
-
hva er varmen av fordampning av gull i kalorier per mol?
-
hva er varmen av fusjon av jern i kalorier per mol?
Svar
-
670 cal
3. 6,98 g
4. 27,10 g
-
8 930 J/g
-
1440 cal/mol
9. 80 600 cal/mol
10. 3530 cal/mol
Leave a Reply