2.11: Intermolecular Erők & Relatív Forró Pont (bp)
Forró pontok, valamint az olvadó pontot
A megfigyelhető olvad, majd forró pontok a különböző szerves molekulák rendelkezik egy további példája a hatását noncovalent kölcsönhatások. Az átfogó elv egyszerű: minél erősebb a molekulák közötti nem-kovalens kölcsönhatás, annál több energiára van szükség hő formájában, hogy szétbontsák őket. A magasabb olvadáspont és forráspont azt jelenti, hogy erősebb nem-kovalens intermolekuláris erők.
vegye figyelembe az egyre nagyobb szénhidrogének forráspontjait. Több karbon nagyobb felületet jelent a hidrofób kölcsönhatáshoz, így magasabb forráspontokat.
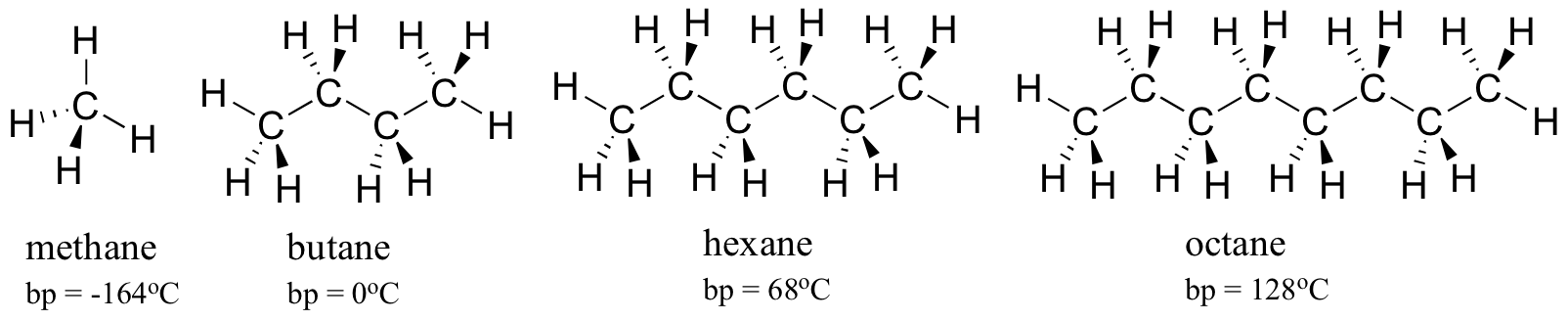
ahogy az várható volt, az intermolekuláris hidrogénkötés és a dipól-dipól kölcsönhatások erőssége magasabb forráspontokban tükröződik. Csak nézzük meg a hexán (csak nem poláris diszperziós kölcsönhatások ), a 3-hexanon (dipól-dipól kölcsönhatások) és a 3-hexanol (hidrogénkötés) tendenciáját.

a biológusok számára különösen érdekes (és nagyjából bármi más, ami az univerzumban él) a hidrogénkötés hatása a vízben. Mivel képes az intermolekuláris hidrogénkötések szoros hálózatát kialakítani, a víz a folyékony fázisban marad 100 OC-ig terjedő hőmérsékleten (kissé alacsonyabb nagy magasságban). A világ nyilvánvalóan nagyon más hely lenne, ha a víz 30 OC-on forralna.
gyakorlat
1. Szerkezetük alapján a fenolt, a benzolt, a benzaldehidet és a benzoesavat a legalacsonyabb és a legmagasabb forráspont között rangsorolják.
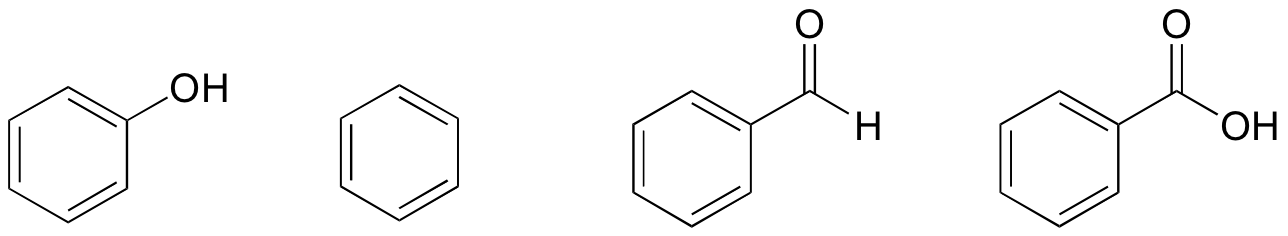
megoldás
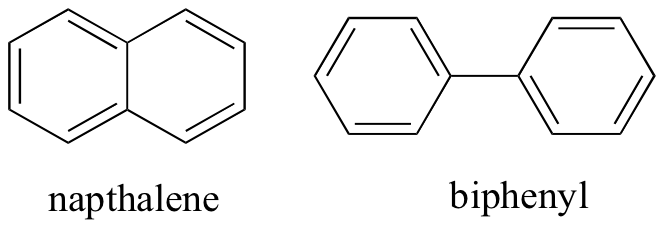
a nemkovalens intermolekuláris kölcsönhatásokra gondolva megjósolhatjuk a relatív olvadáspontokat is. Ugyanazok az elvek érvényesek: az erősebb intermolekuláris kölcsönhatások magasabb olvadáspontot eredményeznek. Az ionos vegyületek, ahogy az várható volt, általában nagyon magas olvadáspontokkal rendelkeznek az ion-ion kölcsönhatások erőssége miatt (vannak olyan ionos vegyületek, amelyek szobahőmérsékleten folyadékok). A poláris, különösen a hidrogénkötő csoportok jelenléte a szerves vegyületeken általában magasabb olvadáspontokhoz vezet. A molekuláris forma, valamint a molekula azon képessége, hogy szorosan egy kristályrácsba csomagoljon, nagyon nagy hatással van az olvadáspontokra. Az aromás vegyületek, mint például a naptalén és a bifenil sík alakja lehetővé teszi számukra, hogy hatékonyan összeragadjanak, így az aromás vegyületek magasabb olvadáspontokkal rendelkeznek, mint a hasonló molekulatömegű alkánok vagy alkének.
összehasonlítva a benzol és a toluol olvadáspontjait, láthatjuk, hogy a toluolon lévő extra metilcsoport megzavarja a molekula veremképességét, ezáltal csökkentve az intermolekuláris londoni diszperziós erők kumulatív erejét.
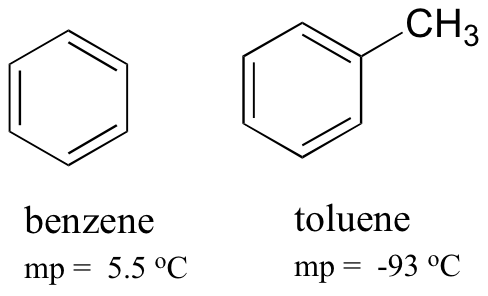
vegye figyelembe azt is, hogy a toluol forráspontja 111 oC, jóval a benzol forráspontja felett (80 oC). A forráspont-trend legfontosabb tényezője ebben az esetben a méret (a toluolnak még egy szénje van), míg az olvadáspont-trendben a forma sokkal fontosabb szerepet játszik. Ez érthető, ha figyelembe vesszük, hogy az olvadó magában foglalja a ‘kicsomagolás a molekulák a megrendelt tömb, mivel az forr magában, hogy egyszerűen elválasztja őket, a már laza (folyékony) egyesület egymással.
ha szerves laboratóriumi tanfolyamot folytat, akkor lehet, hogy már megtudta, hogy a kristályos anyag szennyeződései miatt a megfigyelt olvadáspont alacsonyabb lesz, mint ugyanazon anyag tiszta mintája. Ennek oka, hogy a szennyeződések megzavarják a kristály rendezett csomagolási elrendezését, és gyengítik a kumulatív intermolekuláris kölcsönhatásokat.

a lipidszerkezetek olvadási viselkedése
a molekuláris szerkezet és az olvadáspont közötti kapcsolat érdekes biológiai példáját az állati zsírok, például a szobahőmérsékleten szilárd vaj vagy zsír, valamint a folyékony növényi olajok között megfigyelhető fizikai különbség biztosítja. Mind szilárd zsírok pedig a folyékony olajok alapján ‘triacylglycerol’ szerkezet, ahol három hidrofób szénhidrogén-láncok, különböző hosszúságú csatolták a glicerin gerincét keresztül észter funkcionális csoport (hasonlítsd össze ezt a struktúrát, hogy a membrán lipidek tárgyalt szakasz 2.4 B).
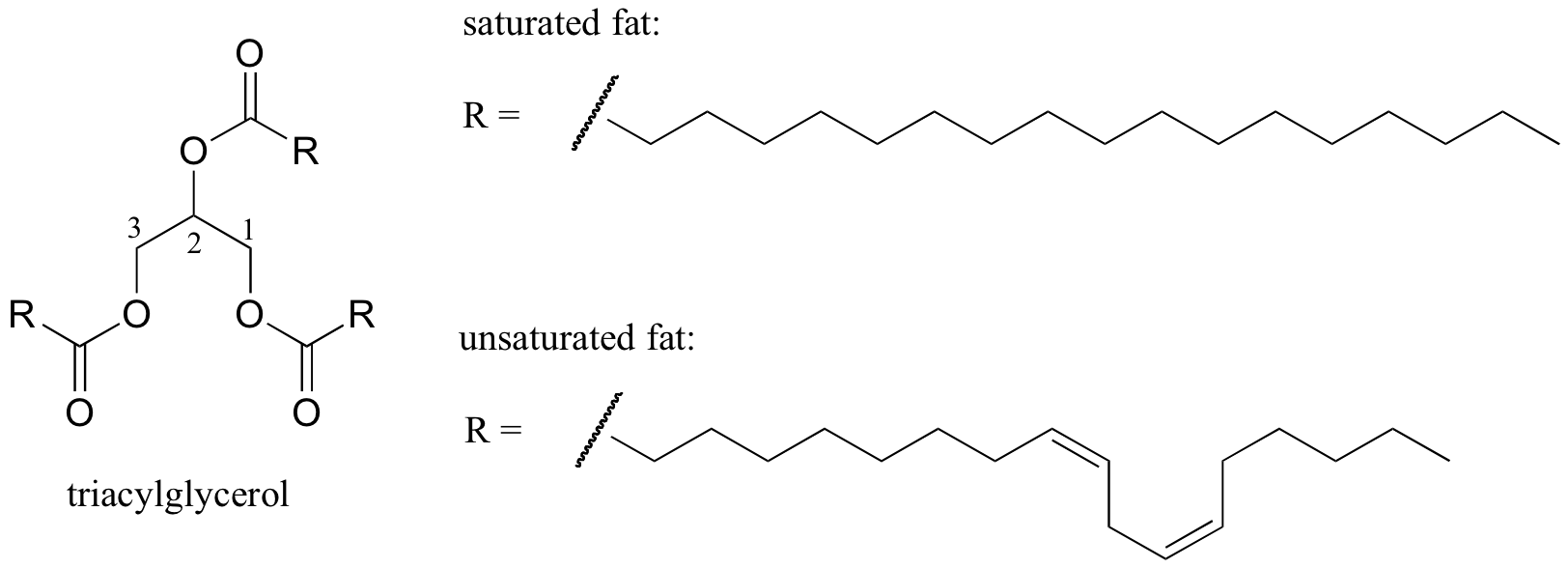
interaktív 3D kép egy telített triacil-glicerinről (biotópok)
telített vs mono-telítetlen zsírsav (biotópok)
növényi olajokban a hidrofób láncok telítetlenek, ami azt jelenti, hogy egy vagy több kettős kötést tartalmaznak. A szilárd állati zsír ezzel szemben telített szénhidrogénláncokat tartalmaz, kettős kötések nélkül. A kettős kötések a növényi olajok, mert azok a szénhidrogén-láncok, hogy több merev, ‘bent’ szögben (ne feledjük, hogy a forgatás korlátozott körül kettős kötések), azzal az eredménnyel, hogy ne pakolj össze olyan szorosan, így lehet törött szét (ie. olvadt) könnyebben. A fenti ábrán látható egy többszörösen telítetlen zsírsavlánc (két kettős kötés), majd kattintson a linkre, hogy interaktív képeket egy telített zsírsav, mint egy egyszeresen telítetlen zsírsav (egy kettős kötés).
gyakorlat
2. Rendezzük a következő vegyületeket csökkenő forráspont szerint.

válasz
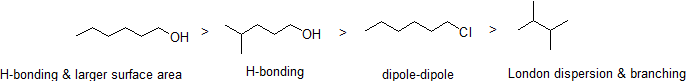
- William Reusch, Professor Emeritus (Michigan State U.), A Szerves Kémia virtuális tankönyve
Szerves Kémia biológiai hangsúlyokkal Tim Soderberg (Minnesota Egyetem, Morris)
Leave a Reply