2.11: intermolekylära krafter & relativa kokpunkter (bp)
kokpunkter och smältpunkter
de observerbara smält-och kokpunkterna för olika organiska molekyler ger en ytterligare illustration av effekterna av icke-kovalenta interaktioner. Den övergripande principen är enkel: Ju starkare de icke-kovalenta interaktionerna mellan molekyler, desto mer energi krävs, i form av värme, för att bryta dem ifrån varandra. Högre smält-och kokpunkter betyder starkare icke-kovalenta intermolekylära krafter.
Tänk på kokpunkterna för allt större kolväten. Mer kol betyder en större yta som är möjlig för hydrofob interaktion och därmed högre kokpunkter.
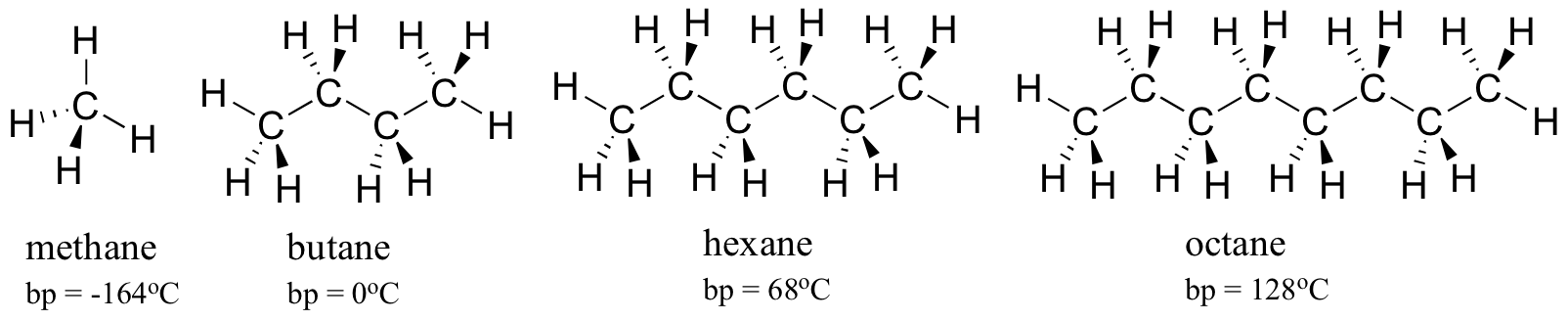
som du förväntar dig återspeglas styrkan hos intermolekylär vätebindning och dipol-dipolinteraktioner i högre kokpunkter. Titta bara på trenden för hexan (endast icke-polära London-dispersionsinteraktioner ), 3-hexanon (dipol-dipolinteraktioner) och 3-hexanol (vätebindning).

av särskilt intresse för biologer (och i stort sett allt annat som lever i universum) är effekten av vätebindning i vatten. Eftersom det kan bilda täta nätverk av intermolekylära vätebindningar förblir vatten i vätskefasen vid temperaturer upp till 100 OC (något lägre vid hög höjd). Världen skulle uppenbarligen vara en helt annan plats om vatten kokades vid 30 OC.
övning
1. Baserat på deras strukturer rankas fenol, bensen, bensaldehydoch bensoesyra i termer av lägsta till högsta kokpunkt.
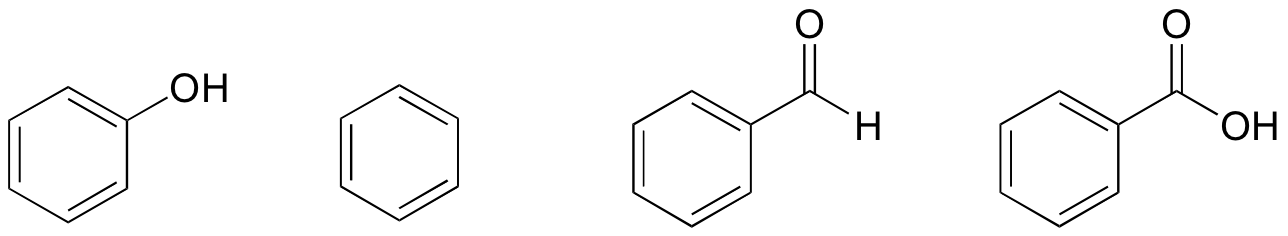
lösning
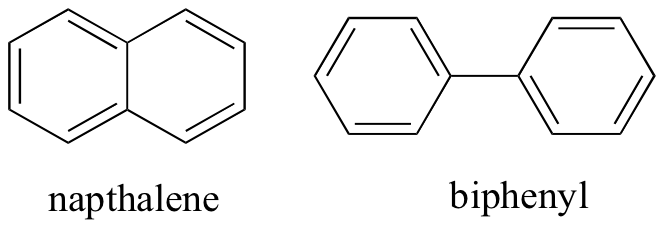
genom att tänka på icke-kovalenta intermolekylära interaktioner kan vi också förutsäga relativa smältpunkter. Alla samma principer gäller: starkare intermolekylära interaktioner resulterar i en högre smältpunkt. Joniska föreningar, som förväntat, har vanligtvis mycket höga smältpunkter på grund av styrkan hos jonjoninteraktioner (det finns dock vissa joniska föreningar som är vätskor vid rumstemperatur). Närvaron av polära och särskilt vätebindningsgrupper på organiska föreningar leder i allmänhet till högre smältpunkter. Molekylär form och förmågan hos en molekyl att packa tätt i en kristallgitter, har en mycket stor effekt på smältpunkter. Den platta formen av aromatiska föreningar såsom naptalen och bifenyl tillåter dem att stapla ihop effektivt, och därmed aromater tenderar att ha högre smältpunkter jämfört med alkaner eller alkener med liknande molekylvikter.
att jämföra smältpunkterna för bensen och toluen kan du se att den extra metylgruppen på toluen stör molekylens förmåga att stapla, vilket minskar den kumulativa styrkan hos intermolekylära London dispersionskrafter.
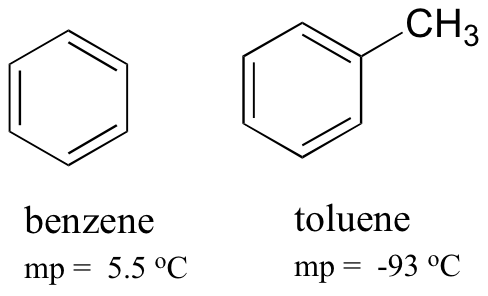
Observera också att kokpunkten för toluen är 111 oC, långt över kokpunkten för bensen (80 oC). Nyckelfaktorn för kokpunktstrenden i detta fall är storlek (toluen har ytterligare ett kol), medan för smältpunktstrenden spelar form en mycket viktigare roll. Detta är vettigt när man tänker på att smältning innebär att man packar upp molekylerna från deras ordnade matris, medan kokning helt enkelt innebär att man skiljer dem från deras redan lösa (flytande) förening med varandra.
Om du tar en organisk laboratoriekurs kanske du redan har lärt dig att föroreningar i en kristallin substans kommer att orsaka att den observerade smältpunkten blir lägre jämfört med ett rent prov av samma ämne. Detta beror på att föroreningar stör det beställda förpackningsarrangemanget av kristallen och gör de kumulativa intermolekylära interaktionerna svagare.

smältbeteendet hos lipidstrukturer
ett intressant biologiskt exempel på förhållandet mellan molekylstruktur och smältpunkt tillhandahålls av den observerbara fysiska skillnaden mellan animaliska fetter som smör eller ister, som är fasta vid rumstemperatur och vegetabiliska oljor, som är flytande. Både fasta fetter och flytande oljor är baserade på en triacylglycerolstruktur, där tre hydrofoba kolvätekedjor av varierande längd är fästa vid en glycerol-ryggrad genom en esterfunktionell grupp (jämför denna struktur med den hos membranlipiderna som diskuteras i avsnitt 2.4 B).
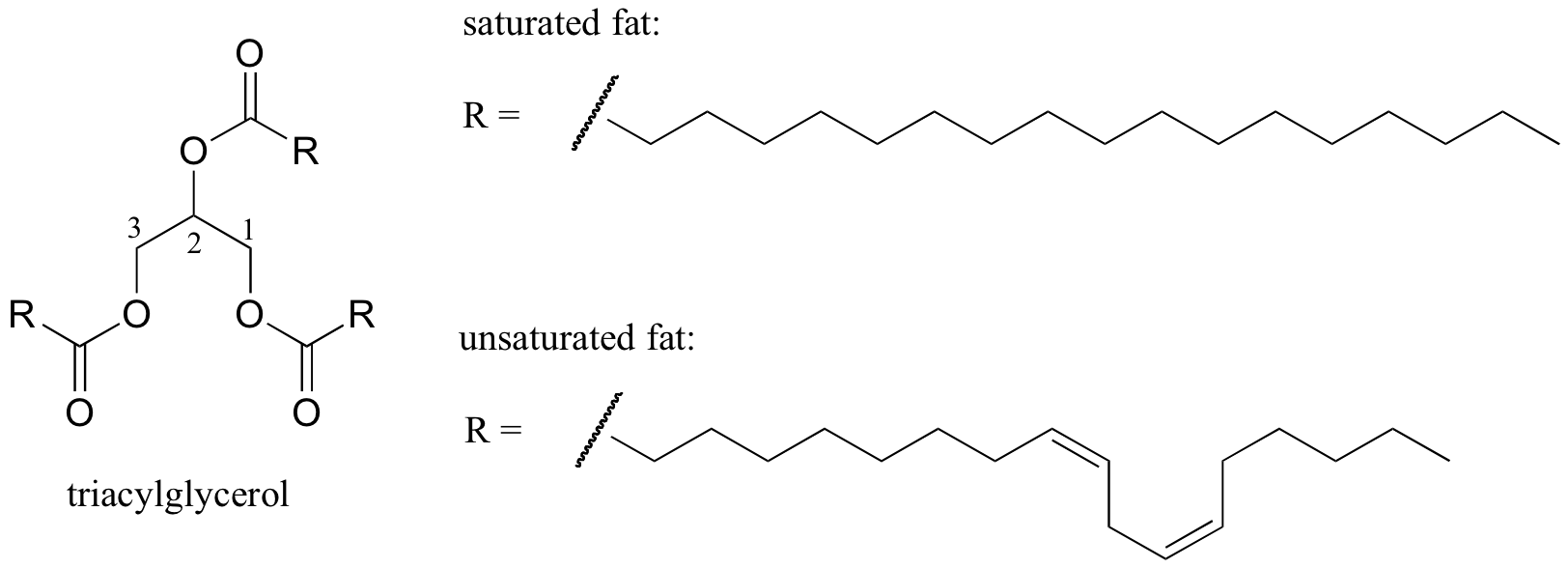
interaktiv 3D-bild av en mättad triacylglycerol (BioTopics)
mättad vs mono-omättad fettsyra (BioTopics)
i vegetabiliska oljor är de hydrofoba kedjorna omättade, vilket innebär att de innehåller en eller flera dubbelbindningar. Fast animaliskt fett innehåller däremot mättade kolvätekedjor utan dubbelbindningar. Dubbelbindningarna i vegetabiliska oljor gör att dessa kolvätekedjor blir styvare och’ böjda ’ i en vinkel (kom ihåg att rotationen är begränsad runt dubbelbindningar), vilket resulterar i att de inte packar ihop så nära och därmed kan brytas isär (dvs. smält) lättare. Visas i figuren ovan är en fleromättad fettsyrakedja (två dubbelbindningar), och du kan klicka på länken för att se interaktiva bilder av en mättad fettsyra jämfört med en enkelomättad fettsyra (en dubbelbindning).
övning
2. Ordna följande föreningar i ordning med minskande kokpunkt.

svar
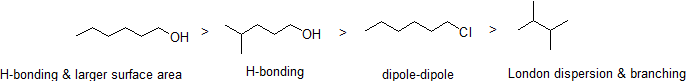
bidragsgivare
- William Reusch, Professor Emeritus (Michigan State U.), Virtuell lärobok för organisk kemi
organisk kemi med biologisk betoning av Tim Soderberg (University of Minnesota, Morris)
Leave a Reply