2.11: Fuerzas Intermoleculares y Puntos de Ebullición Relativos (pa)
Puntos de ebullición y puntos de fusión
Los puntos de ebullición y fusión observables de diferentes moléculas orgánicas proporcionan una ilustración adicional de los efectos de las interacciones no covalentes. El principio general involucrado es simple: cuanto más fuertes sean las interacciones no covalentes entre las moléculas, más energía se requiere, en forma de calor, para separarlas. Los puntos de fusión y ebullición más altos significan fuerzas intermoleculares no covalentes más fuertes.
Considere los puntos de ebullición de hidrocarburos cada vez más grandes. Más carbonos significa una mayor área de superficie posible para la interacción hidrofóbica y, por lo tanto, puntos de ebullición más altos.
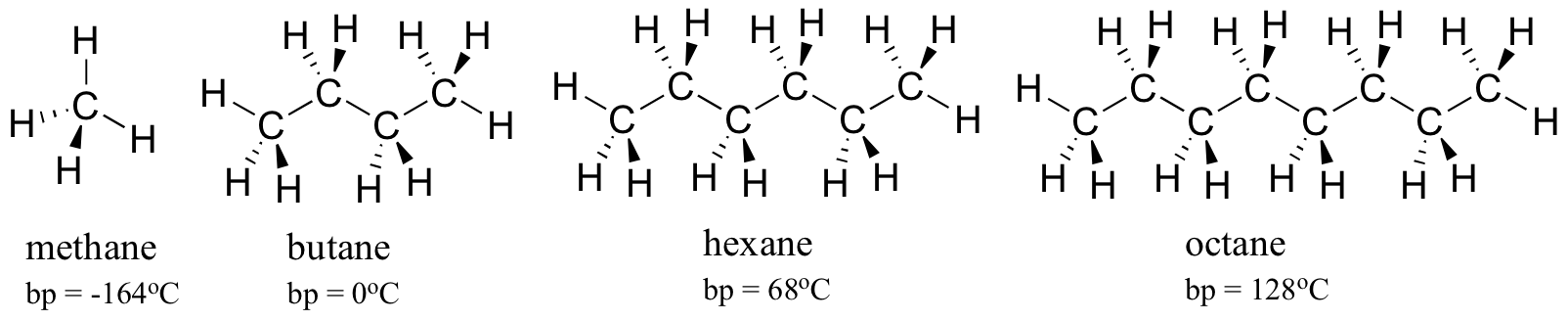
Como era de esperar, la fuerza de la unión de hidrógeno intermolecular y las interacciones dipolo-dipolo se refleja en puntos de ebullición más altos. Basta con observar la tendencia de hexano (interacciones de dispersión de Londres no polares solamente), 3-hexanona (interacciones dipolo-dipolo) y 3-hexanol (enlace de hidrógeno).

De particular interés para los biólogos (y casi cualquier otra cosa que esté viva en el universo) es el efecto de la unión de hidrógeno en el agua. Debido a que es capaz de formar redes estrechas de enlaces de hidrógeno intermoleculares, el agua permanece en la fase líquida a temperaturas de hasta 100 OC, (ligeramente más bajas a gran altitud). El mundo, obviamente, sería un lugar muy diferente si el agua hierve a 30 OC.
Ejercicio
1. En función de sus estructuras, clasifica el fenol, el benceno, el benzaldehído y el ácido benzoico en términos de punto de ebullición más bajo a más alto.
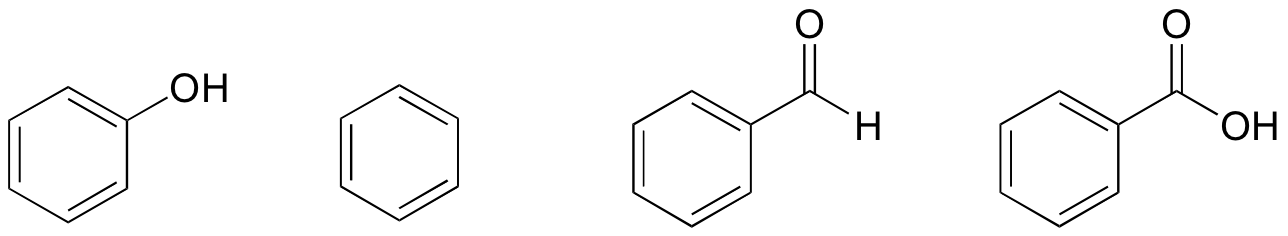
Solución
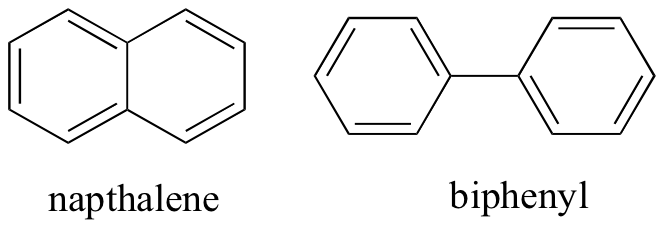
Al pensar en las interacciones intermoleculares no covalentes, también podemos predecir los puntos de fusión relativos. Se aplican todos los mismos principios: las interacciones intermoleculares más fuertes dan como resultado un punto de fusión más alto. Los compuestos iónicos, como es de esperar, generalmente tienen puntos de fusión muy altos debido a la fuerza de las interacciones ion-ion (hay algunos compuestos iónicos, sin embargo, que son líquidos a temperatura ambiente). La presencia de grupos de enlace polar y especialmente de hidrógeno en compuestos orgánicos generalmente conduce a puntos de fusión más altos. La forma molecular, y la capacidad de una molécula para empaquetarse firmemente en una red de cristal, tiene un efecto muy grande en los puntos de fusión. La forma plana de compuestos aromáticos como el naptaleno y el bifenilo les permite apilarse de manera eficiente, y por lo tanto los aromáticos tienden a tener puntos de fusión más altos en comparación con los alcanos o alquenos con pesos moleculares similares.
Comparando los puntos de fusión del benceno y el tolueno, se puede ver que el grupo metilo extra en el tolueno interrumpe la capacidad de la molécula para acumularse, disminuyendo así la fuerza acumulada de las fuerzas de dispersión intermolecular de Londres.
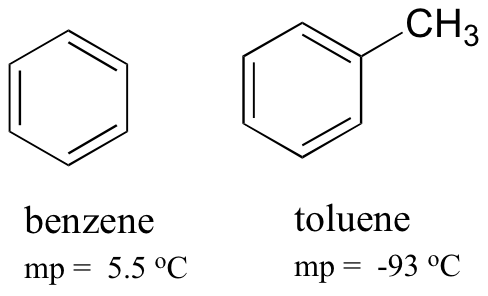
Tenga en cuenta también que el punto de ebullición del tolueno es de 111 oC, muy por encima del punto de ebullición del benceno (80 oC). El factor clave para la tendencia del punto de ebullición en este caso es el tamaño (el tolueno tiene un carbono más), mientras que para la tendencia del punto de fusión, la forma juega un papel mucho más importante. Esto tiene sentido cuando se considera que la fusión implica «desempaquetar» las moléculas de su matriz ordenada, mientras que la ebullición implica simplemente separarlas de su asociación (líquida) ya suelta entre sí.
Si está tomando un curso de laboratorio orgánico, es posible que ya haya aprendido que las impurezas en una sustancia cristalina harán que el punto de fusión observado sea menor en comparación con una muestra pura de la misma sustancia. Esto se debe a que las impurezas interrumpen la disposición ordenada del cristal y debilitan las interacciones intermoleculares acumulativas.

El comportamiento de fusión de las estructuras lipídicas
Un ejemplo biológico interesante de la relación entre la estructura molecular y el punto de fusión es la diferencia física observable entre las grasas animales como la mantequilla o la manteca de cerdo, que son sólidas a temperatura ambiente, y los aceites vegetales, que son líquidos. Tanto las grasas sólidas como los aceites líquidos se basan en una estructura de «triacilglicerol», en la que tres cadenas de hidrocarburos hidrofóbicos de longitud variable se unen a una columna vertebral de glicerol a través de un grupo funcional éster (compare esta estructura con la de los lípidos de membrana discutidos en la sección 2.4 B).
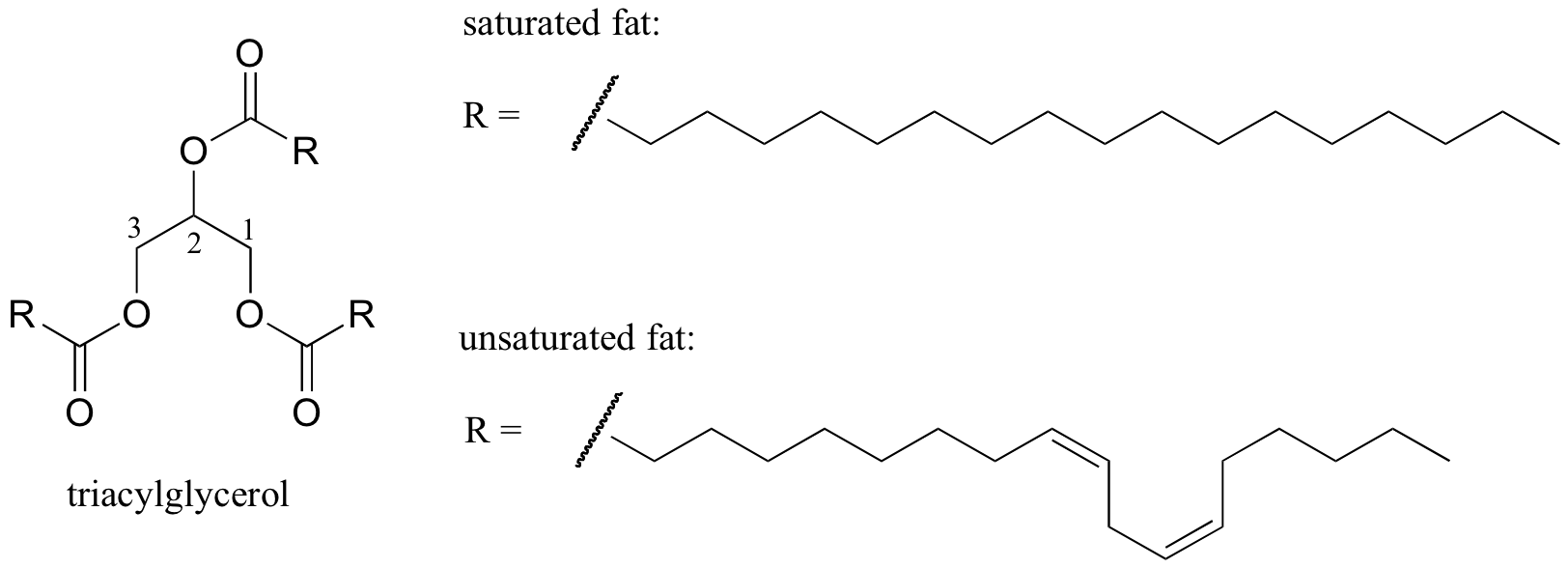
Imagen interactiva en 3D de un triacilglicerol saturado (biotópicos)
Ácido graso saturado vs monoinsaturado (biotópicos)
En los aceites vegetales, las cadenas hidrofóbicas son insaturadas, lo que significa que contienen uno o más enlaces dobles. La grasa animal sólida, por el contrario, contiene cadenas de hidrocarburos saturados, sin dobles enlaces. Los enlaces dobles en los aceites vegetales hacen que las cadenas de hidrocarburos sean más rígidas y ‘dobladas’ en un ángulo (recuerde que la rotación está restringida alrededor de los enlaces dobles), con el resultado de que no se empaquetan tan juntas y, por lo tanto, se pueden romper (es decir,. derretido) más fácilmente. En la figura de arriba se muestra una cadena de ácidos grasos poliinsaturados (dos enlaces dobles), y puede hacer clic en el enlace para ver imágenes interactivas de un ácido graso saturado en comparación con un ácido graso monoinsaturado (un enlace doble).
Ejercicio
2. Organice los siguientes compuestos en orden decreciente del punto de ebullición.

Answer
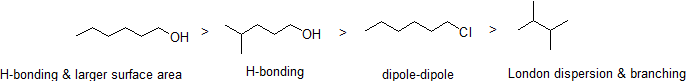
Colaboradores
- William Reusch, Profesor Emérito (Michigan State U.), Virtual de libros de texto de Química Orgánica
de Química Orgánica Biológica Énfasis por Tim Soderberg (Universidad de Minnesota, Morris)
Leave a Reply