2.11: Forças Intermoleculares & Relativa de Pontos de Ebulição (bp)
pontos de Ebulição e ponto de fusão
observável de fusão e pontos de ebulição de diferentes moléculas orgânicas oferece uma ilustração dos efeitos da noncovalent medicamentosas. O princípio geral envolvido é simples: quanto mais fortes são as interações não-inovalentes entre moléculas, mais energia é necessária, na forma de calor, para quebrá-las. Pontos de fusão e de ebulição mais elevados significam forças intermoleculares não-renováveis mais fortes. considere os pontos de ebulição de hidrocarbonetos cada vez mais grandes. Mais Carbões significa uma maior área de superfície possível para a interação hidrofóbica, e, portanto, pontos de ebulição mais elevados.
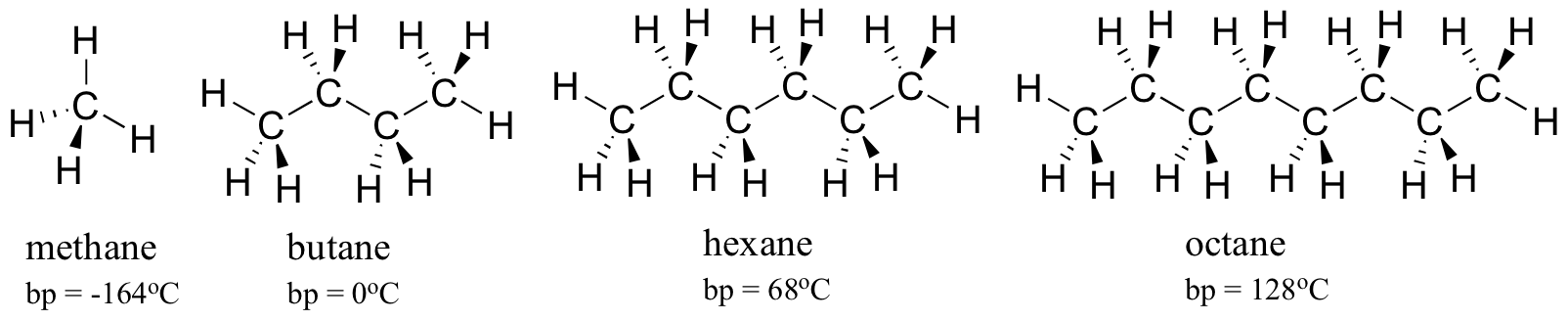
Como seria de esperar, a resistência da ligação intermolecular de hidrogénio e das interacções dipolo-dipolo reflecte-se em pontos de ebulição mais elevados. Basta olhar para a tendência para o hexano (apenas interações de dispersão não-polares de Londres), 3-hexanona (interações dipolo-dipolo) e 3-hexanol (ligação de hidrogénio).

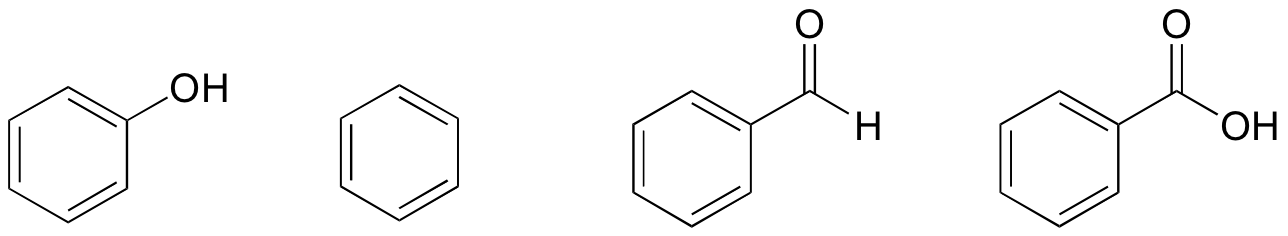
de particular interesse para os biólogos (e praticamente qualquer outra coisa que está viva no universo) é o efeito da ligação do hidrogênio na água. Como é capaz de formar redes estreitas de ligações intermoleculares de hidrogênio, a água permanece na fase líquida a temperaturas até 100 OC, (um pouco mais baixa a alta altitude). O mundo seria obviamente um lugar muito diferente se a água fervesse a 30 OC.Exercício Exercício Exercício 1. Based on their structures, rank fenol, benzene, benzaldeído, and benzoic acid in terms of lowest to highest boiling point.
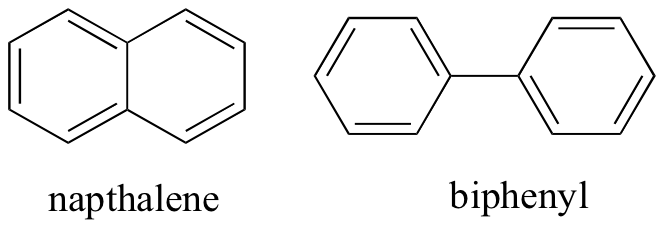
pensando em interações intermoleculares não-coloridas, também podemos prever pontos de fusão relativos. Todos os mesmos princípios se aplicam: interações intermoleculares mais fortes resultam em um ponto de fusão mais elevado. Compostos iônicos, como esperado, geralmente têm pontos de fusão muito altos devido à força das interações iônicas (existem alguns compostos iônicos, no entanto, que são líquidos à temperatura ambiente). A presença de grupos polares e especialmente de ligação de hidrogênio em compostos orgânicos geralmente leva a pontos de fusão mais elevados. A forma Molecular, e a capacidade de uma molécula se encaixar firmemente em uma estrutura de cristal, tem um efeito muito grande nos pontos de fusão. A forma plana de compostos aromáticos, tais como naptaleno e bifenilo, permite que eles se empilhem eficientemente, e assim os aromáticos tendem a ter pontos de fusão mais elevados em comparação com alcanos ou alcenos com pesos moleculares similares.
comparando os pontos de fusão de benzeno e tolueno, você pode ver que o grupo extra de metil em tolueno perturba a capacidade da molécula de empilhar, diminuindo assim a força cumulativa das forças intermoleculares de dispersão de Londres.
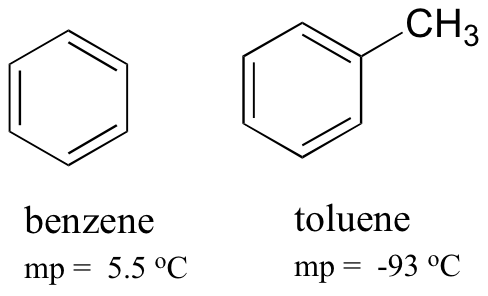
Note also that the boiling point for toluene is 111 oC, well above the boiling point of benzene (80 oC). O fator chave para a tendência do ponto de ebulição neste caso é o tamanho (tolueno tem mais um carbono), enquanto para a tendência do ponto de fusão, a forma desempenha um papel muito mais importante. Isso faz sentido quando você considera que o derretimento envolve “desembalar” as moléculas de sua matriz ordenada, enquanto a ebulição envolve simplesmente separá-las de sua Associação (líquida) já frouxa entre si.se está a fazer um curso de laboratório orgânico, pode já ter aprendido que as impurezas numa substância cristalina farão com que o ponto de fusão observado seja mais baixo em comparação com uma amostra pura da mesma substância. Isso ocorre porque as impurezas interrompem o arranjo de embalagem ordenado do cristal, e tornam as interações intermoleculares cumulativas mais fracas.

O comportamento de fusão de lipídios estruturas
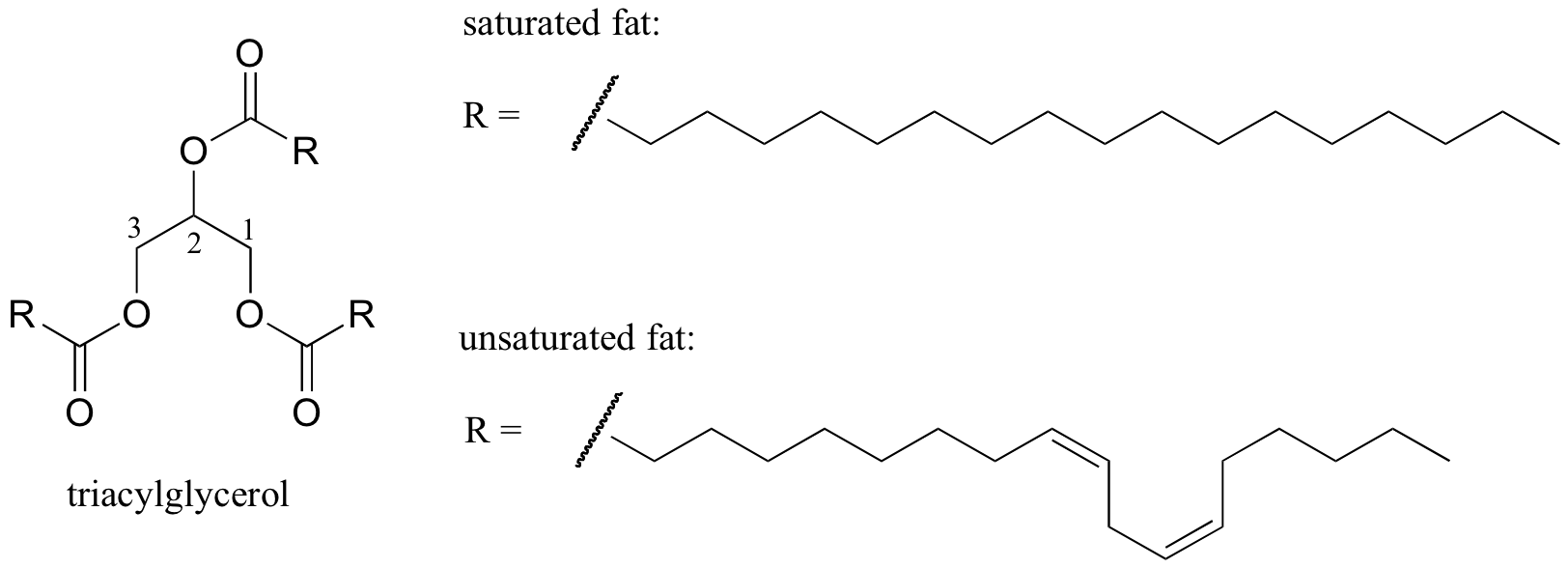
Um interessante exemplo biológico da relação entre a estrutura molecular e ponto de fusão é fornecido pelo observáveis diferença física entre as gorduras animais como manteiga ou banha de porco, que são sólidas à temperatura ambiente, e óleos vegetais, que são líquidos. Tanto as gorduras sólidas como os óleos líquidos baseiam-se numa estrutura de “triacilglicerol”, em que três cadeias hidrofóbicas de hidrocarbonetos de comprimento variável são ligadas a uma coluna vertebral de glicerol através de um grupo funcional de éster (comparar esta estrutura com a dos lípidos de membrana discutidos na secção 2.4 B).
 saturado vs ácido gordo mono-insaturado (Biotópicos)
saturado vs ácido gordo mono-insaturado (Biotópicos)
em óleos vegetais, as cadeias hidrofóbicas são insaturadas, o que significa que contêm uma ou mais ligações duplas. A gordura animal sólida, em contraste, contém cadeias de hidrocarbonetos saturadas, sem ligações duplas. As ligações duplas em óleos vegetais fazem com que essas cadeias de hidrocarbonetos sejam mais rígidas ,e “dobradas” em um ângulo (lembre-se que a rotação é restrita em torno de ligações duplas), com o resultado de que eles não empacotam juntos tão perto, e assim podem ser quebradas (ie. derretido) mais facilmente. Mostrado na figura acima é uma cadeia de ácidos graxos polinsaturados (duas ligações duplas), e você pode clicar no link para ver imagens interativas de um ácido graxo saturado em comparação com um ácido graxo monoinsaturado (uma ligação dupla).2. Organizar os seguintes compostos por ordem decrescente do ponto de ebulição.

resposta
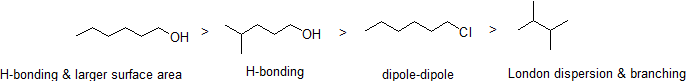
contribuintes
- William Reusch, Professor Emérito (Michigan State U.), Livro Virtual de Química Orgânica
Química Orgânica, Com Ênfase Biológica por Tim Soderberg (Universidade de Minnesota, Morris)
Leave a Reply