2.11: Forze intermolecolari e relativi punti di ebollizione (bp)
Punti di ebollizione e punti di fusione
La fusione osservabile e punti di ebollizione di diverse molecole organiche fornisce un’ulteriore illustrazione degli effetti delle interazioni non covalenti. Il principio generale coinvolto è semplice: più forti sono le interazioni non covalenti tra le molecole, maggiore è l’energia necessaria, sotto forma di calore, per separarle. Punti di fusione e di ebollizione più elevati significano forze intermolecolari non covalenti più forti.
Considera i punti di ebollizione di idrocarburi sempre più grandi. Più carboni significa una maggiore superficie possibile per l’interazione idrofobica e quindi punti di ebollizione più elevati.
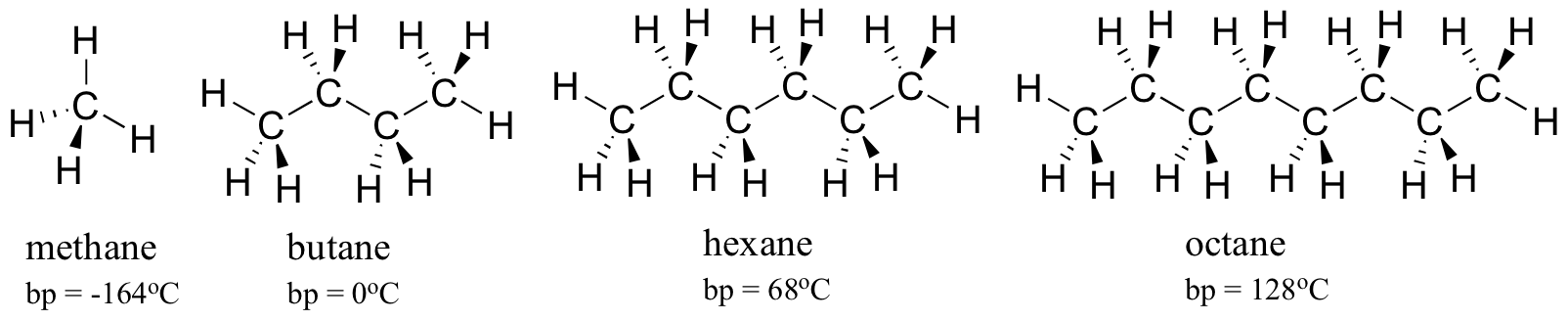
Come ci si aspetterebbe, la forza del legame idrogeno intermolecolare e delle interazioni dipolo-dipolo si riflette in punti di ebollizione più alti. Basta guardare la tendenza per esano (solo interazioni di dispersione di Londra non polare ), 3-esanone (interazioni dipolo-dipolo) e 3-esanolo (legame idrogeno).

Di particolare interesse per i biologi (e praticamente qualsiasi altra cosa che è viva nell’universo) è l’effetto del legame dell’idrogeno nell’acqua. Poiché è in grado di formare reti strette di legami idrogeno intermolecolari, l’acqua rimane in fase liquida a temperature fino a 100 OC, (leggermente più basse in alta quota). Il mondo sarebbe ovviamente un posto molto diverso se l’acqua bollisse a 30 OC.
Esercizio
1. Sulla base delle loro strutture, classifica fenolo, benzene, benzaldeide e acido benzoico in termini di punto di ebollizione più basso al più alto.
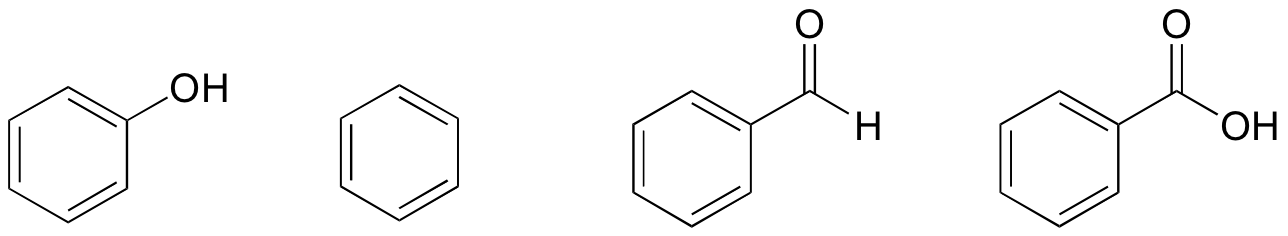
Soluzione
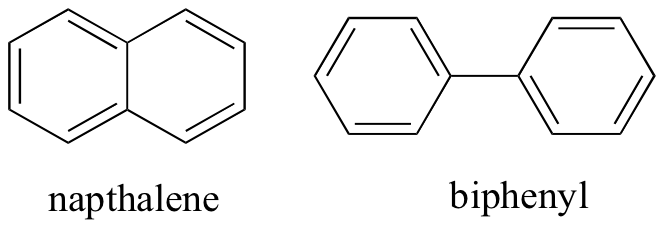
Pensando alle interazioni intermolecolari non covalenti, possiamo anche prevedere i punti di fusione relativi. Tutti gli stessi principi si applicano: interazioni intermolecolari più forti provocano un punto di fusione più elevato. I composti ionici, come previsto, di solito hanno punti di fusione molto elevati a causa della forza delle interazioni ion-ion (ci sono alcuni composti ionici, tuttavia, che sono liquidi a temperatura ambiente). La presenza di gruppi polari e in particolare di legame idrogeno su composti organici porta generalmente a punti di fusione più elevati. La forma molecolare e la capacità di una molecola di imballare strettamente in un reticolo cristallino, hanno un effetto molto grande sui punti di fusione. La forma piatta di composti aromatici come il naftalene e il bifenile consente loro di impilare insieme in modo efficiente, e quindi gli aromatici tendono ad avere punti di fusione più elevati rispetto agli alcani o agli alcheni con pesi molecolari simili.
Confrontando i punti di fusione del benzene e del toluene, si può vedere che il gruppo metilico extra sul toluene interrompe la capacità della molecola di impilarsi, diminuendo così la forza cumulativa delle forze di dispersione intermolecolari di Londra.
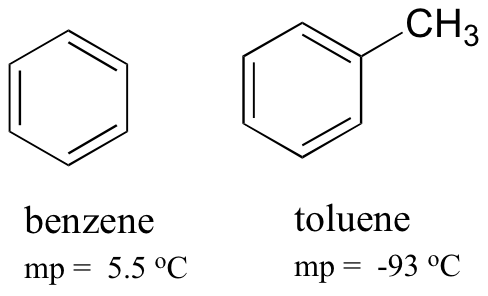
Si noti inoltre che il punto di ebollizione per il toluene è 111 oC, ben al di sopra del punto di ebollizione del benzene (80 oC). Il fattore chiave per la tendenza del punto di ebollizione in questo caso è la dimensione (il toluene ha un altro carbonio), mentre per la tendenza del punto di fusione, la forma gioca un ruolo molto più importante. Ciò ha senso se si considera che la fusione comporta il “disimballaggio” delle molecole dalla loro matrice ordinata, mentre l’ebollizione comporta semplicemente la separazione tra loro dalla loro associazione (liquida) già sciolta.
Se stai seguendo un corso di laboratorio organico, potresti aver già appreso che le impurità in una sostanza cristallina causeranno un abbassamento del punto di fusione osservato rispetto a un campione puro della stessa sostanza. Questo perché le impurità interrompono la disposizione ordinata dell’imballaggio del cristallo e rendono più deboli le interazioni intermolecolari cumulative.

Il comportamento di fusione delle strutture lipidiche
Un interessante esempio biologico della relazione tra struttura molecolare e punto di fusione è fornito dalla differenza fisica osservabile tra grassi animali come burro o strutto, che sono solidi a temperatura ambiente, e oli vegetali, che sono liquidi. Sia i grassi solidi che gli oli liquidi si basano su una struttura di “triacilglicerolo”, in cui tre catene idrofobiche di idrocarburi di lunghezza variabile sono attaccate a una spina dorsale di glicerolo attraverso un gruppo funzionale estere (confrontare questa struttura con quella dei lipidi di membrana discussi nella sezione 2.4 B).
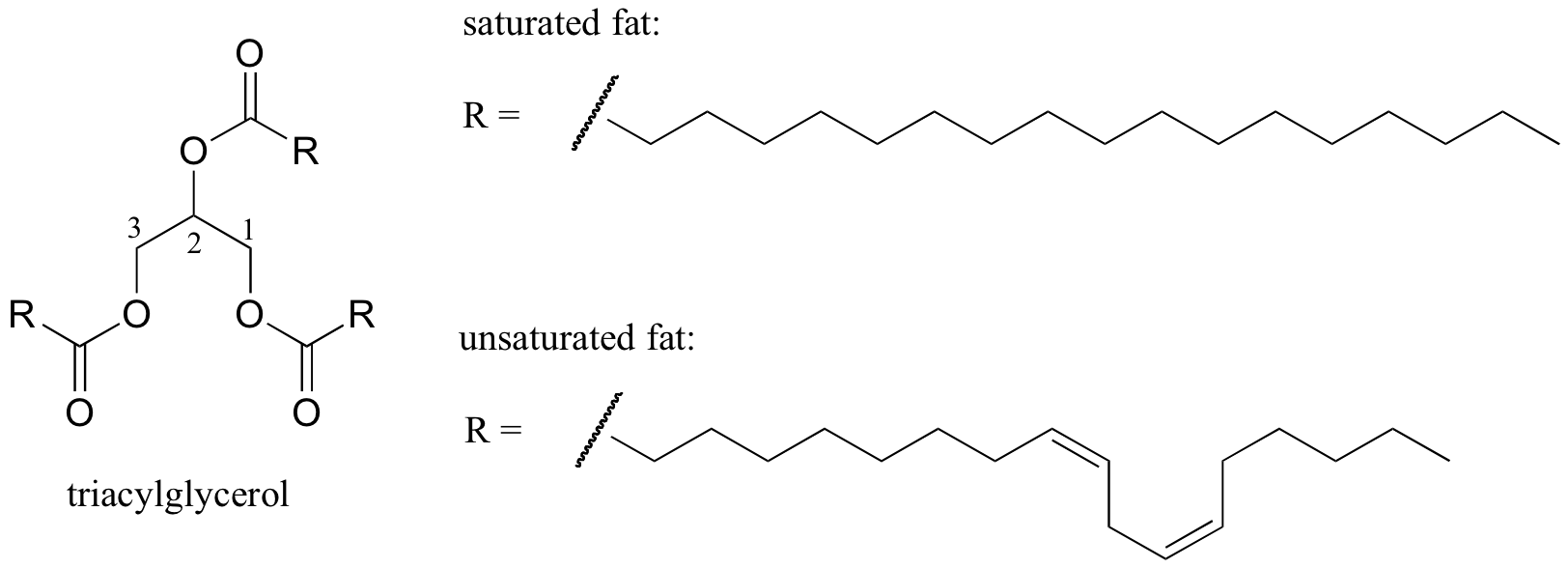
Immagine 3D interattiva di un triacilglicerolo saturo (BioTopics)
Acido grasso saturo vs mono-insaturo (BioTopics)
Negli oli vegetali, le catene idrofobiche sono insature, il che significa che contengono uno o più doppi legami. Il grasso animale solido, al contrario, contiene catene di idrocarburi saturi, senza doppi legami. I doppi legami negli oli vegetali fanno sì che quelle catene idrocarburiche siano più rigide e “piegate” ad angolo (ricorda che la rotazione è limitata attorno ai doppi legami), con il risultato che non si raggruppano più da vicino e quindi possono essere spezzate (es. fuso) più facilmente. Mostrato nella figura sopra è una catena di acidi grassi polinsaturi (due doppi legami), ed è possibile fare clic sul link per vedere le immagini interattive di un acido grasso saturo rispetto ad un acido grasso monoinsaturo (un doppio legame).
Esercizio
2. Disporre i seguenti composti in ordine decrescente di punto di ebollizione.

Risposta
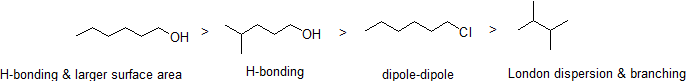
Contributori
- William Reusch, Professore emerito (Michigan State U.), Libro di testo virtuale di chimica organica
Chimica organica con enfasi biologica di Tim Soderberg (Università del Minnesota, Morris)
Leave a Reply