2.11: intermoleculaire krachten & relatieve kookpunten (bp)
kookpunten en smeltpunten
de waarneembare smelt-en kookpunten van verschillende organische moleculen geven een extra illustratie van de effecten van niet-kovalente interacties. Het overkoepelende principe is eenvoudig: hoe sterker de niet-kovalente interacties tussen moleculen, hoe meer energie die nodig is, in de vorm van warmte, om ze uit elkaar te breken. Hogere smelt-en kookpunten betekenen sterkere noncovalente intermoleculaire krachten.
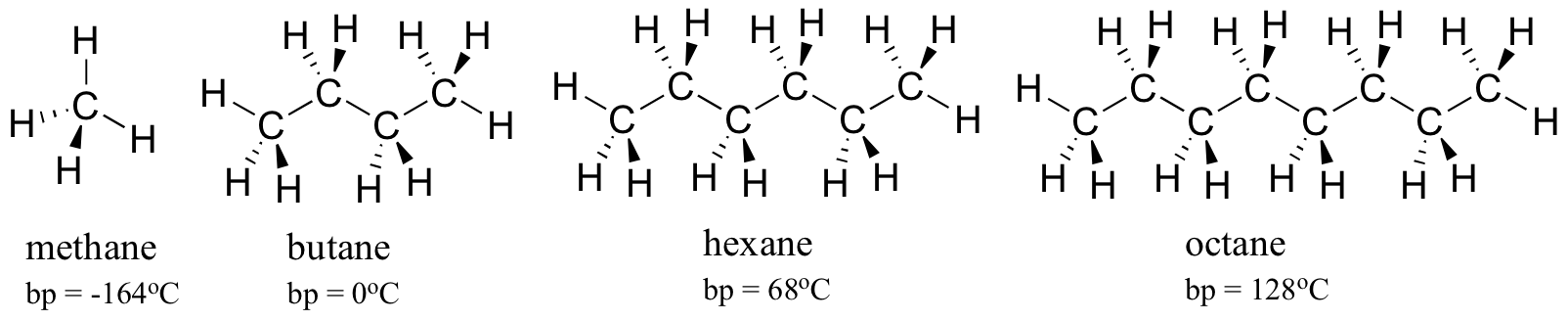
overweeg het kookpunt van steeds grotere koolwaterstoffen. Meer koolstof betekent een groter oppervlak mogelijk voor hydrofobe interactie, en dus hogere kookpunten.
zoals je zou verwachten, wordt de sterkte van intermoleculaire waterstofbindingen en dipooldipoolinteracties weerspiegeld in hogere kookpunten. Kijk maar naar de trend voor hexaan (alleen Nonpolaire Londense dispersieinteracties ), 3-hexanon (dipooldipoolinteracties) en 3-hexanol (waterstofbindingen).

van bijzonder belang voor biologen (en vrijwel alles wat in het heelal leeft) is het effect van waterstofbinding in water. Omdat het in staat is om strakke netwerken van intermoleculaire waterstofbindingen te vormen, blijft water in de vloeibare fase bij temperaturen tot 100 OC (iets lager op grote hoogte). De wereld zou natuurlijk heel anders zijn als water op 30 OC zou koken.
oefening
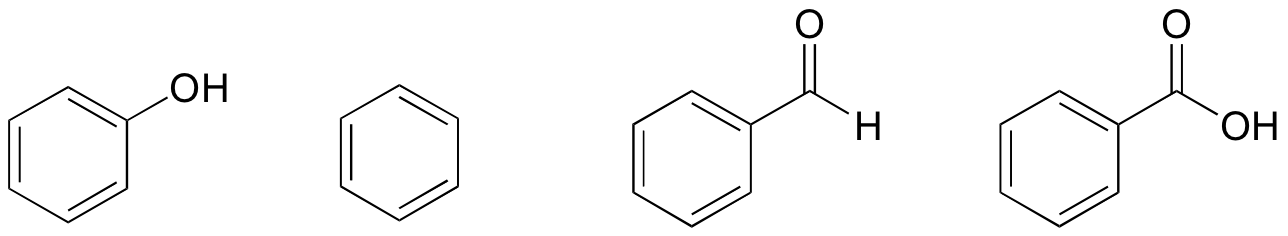
1. Gebaseerd op hun structuren, rang fenol, benzeen, benzaldehyde, en benzoëzuur in termen van laagste tot hoogste kookpunt.
oplossing
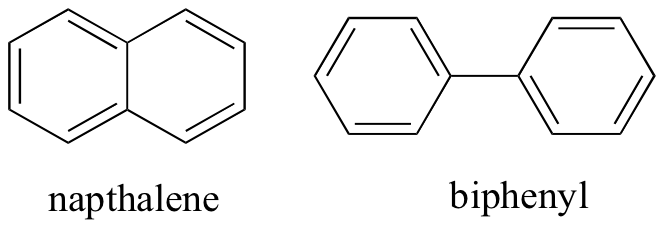
door na te denken over niet-kovalente intermoleculaire interacties, kunnen we ook relatieve smeltpunten voorspellen. Alle dezelfde principes zijn van toepassing: sterkere intermoleculaire interacties resulteren in een hoger smeltpunt. Ionverbindingen, zoals verwacht, hebben meestal zeer hoge smeltpunten als gevolg van de sterkte van ion-ion interacties (er zijn echter sommige ionverbindingen die vloeistoffen zijn bij kamertemperatuur). De aanwezigheid van polaire en vooral waterstofbindende groepen op organische verbindingen leidt in het algemeen tot hogere smeltpunten. Moleculaire vorm, en het vermogen van een molecuul om strak in een kristalrooster te verpakken, heeft een zeer groot effect op smeltpunten. De vlakke vorm van aromatische verbindingen zoals napthaleen en bifenyl staat hen toe om efficiënt samen te stapelen, en zo neigen aromaten om hogere smeltpunten te hebben in vergelijking met alkanen of alkenen met gelijkaardige molecuulgewichten.
wanneer je de smeltpunten van benzeen en tolueen vergelijkt, kun je zien dat de extra methylgroep op tolueen het vermogen van het molecuul verstoort om te stapelen, waardoor de cumulatieve sterkte van de intermoleculaire Londense dispersiekrachten afneemt.
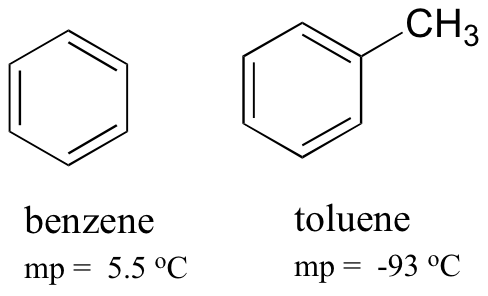
merk ook op dat het kookpunt voor tolueen 111 oC is, ruim boven het kookpunt van benzeen (80 oC). De belangrijkste factor voor de kookpunttrend in dit geval is de grootte (tolueen heeft nog een koolstof), terwijl voor de smeltpunttrend de vorm een veel belangrijkere rol speelt. Dit is logisch als je bedenkt dat smelten inhoudt dat de moleculen uit hun geordende array worden ‘uitgepakt’, terwijl koken simpelweg inhoudt dat ze worden gescheiden van hun reeds losse (vloeibare) associatie met elkaar.
Als u een organische laboratorium cursus volgt, heeft u misschien al geleerd dat onzuiverheden in een kristallijne stof ervoor zorgen dat het waargenomen smeltpunt lager is in vergelijking met een zuiver monster van dezelfde stof. Dit komt omdat onzuiverheden verstoren de bestelde verpakking regeling van het kristal, en maken de cumulatieve intermoleculaire interacties zwakker.

het smeltgedrag van lipidenstructuren
een interessant biologisch voorbeeld van de relatie tussen moleculaire structuur en smeltpunt wordt gegeven door het waarneembare fysieke verschil tussen dierlijke vetten zoals boter of reuzel, die bij kamertemperatuur vast zijn, en plantaardige oliën, die vloeibaar zijn. Zowel vaste vetten als vloeibare oliën zijn gebaseerd op een ’triacylglycerol’ – structuur, waarbij drie hydrofobe koolwaterstofketens van verschillende lengte via een functionele estergroep aan een glycerolbeenketen zijn bevestigd (vergelijk deze structuur met die van de membraanlipiden besproken in punt 2.4 B).
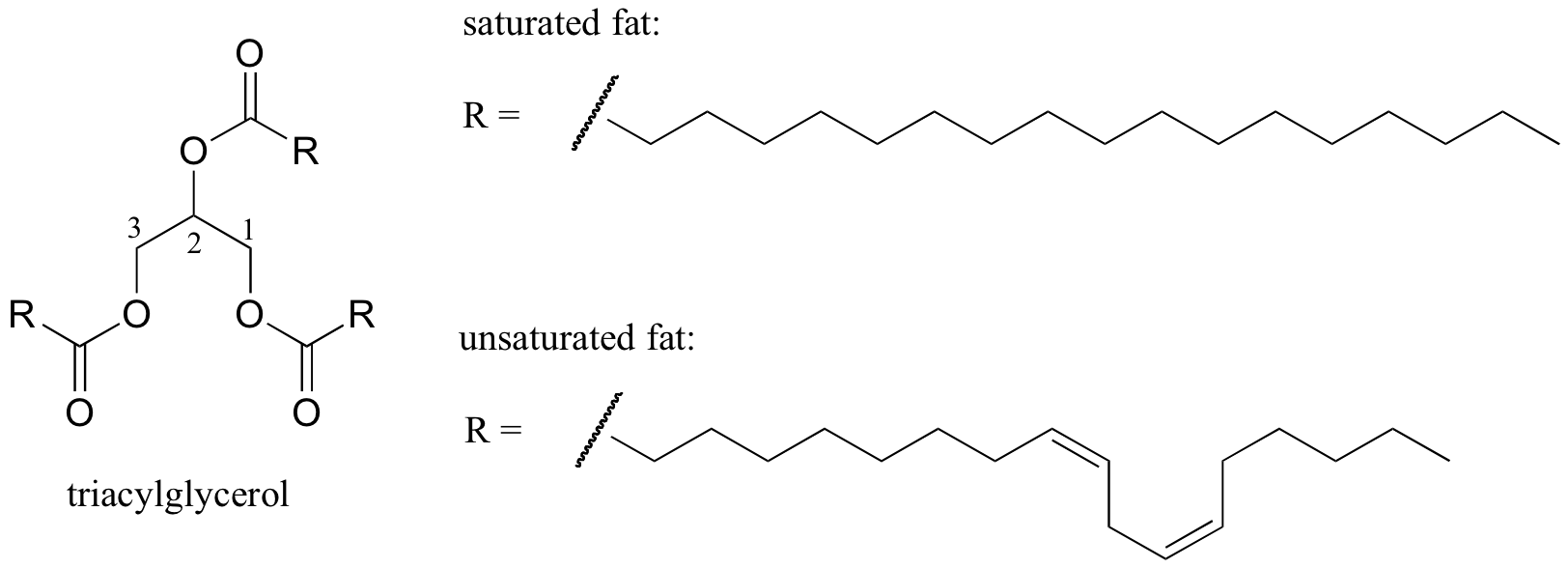
interactieve 3D-afbeelding van een verzadigd triacylglycerol (BioTopics)
verzadigd Versus mono-onverzadigd vetzuur (BioTopics)
in plantaardige oliën zijn de hydrofobe ketens onverzadigd, wat betekent dat ze één of meer dubbele bindingen bevatten. Vast dierlijk vet daarentegen bevat verzadigde koolwaterstofketens, zonder dubbele bindingen. De dubbele bindingen in plantaardige oliën zorgen ervoor dat die koolwaterstofketens steviger en’ gebogen ‘ zijn onder een hoek (vergeet niet dat rotatie beperkt is rond dubbele bindingen), met als gevolg dat ze niet zo dicht bij elkaar verpakken, en dus uit elkaar kunnen worden gebroken (dwz. gesmolten) gemakkelijker. In de bovenstaande figuur is een meervoudig onverzadigde vetzuurketen (twee dubbele bindingen) weergegeven, en u kunt op de link klikken om interactieve beelden te zien van een verzadigd vetzuur vergeleken met een enkelvoudig onverzadigd vetzuur (één dubbele binding).
oefening
2. Schik de volgende verbindingen in volgorde van afnemende kookpunt.

antwoord
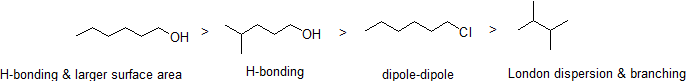
bijdragers
- William Reussch, emeritus hoogleraar (Michigan State U.), Virtual Textbook of Organic Chemistry
organische chemie met een biologische nadruk door Tim Soderberg (University Of Minnesota, Morris)
Leave a Reply