2.11: Intermolecular Forces & Relative Boiling Points (bp)
Boiling points ja sulamispisteet
eri orgaanisten molekyylien havaittavat sulamis-ja kiehumispisteet antavat lisäkuvauksen ei-valenttisten vuorovaikutusten vaikutuksista. Tähän liittyvä yleinen periaate on yksinkertainen: mitä voimakkaampia molekyylien väliset epäsovinnaiset vuorovaikutukset ovat, sitä enemmän energiaa tarvitaan niiden hajottamiseen lämmön muodossa. Korkeammat sulamis-ja kiehumispisteet merkitsevät voimakkaampia molekyylien välisiä voimia.
tarkastellaan yhä suurempien hiilivetyjen kiehumispisteitä. Enemmän hiiltä tarkoittaa hydrofobiselle vuorovaikutukselle mahdollista suurempaa pinta-alaa ja siten korkeampia kiehumispisteitä.
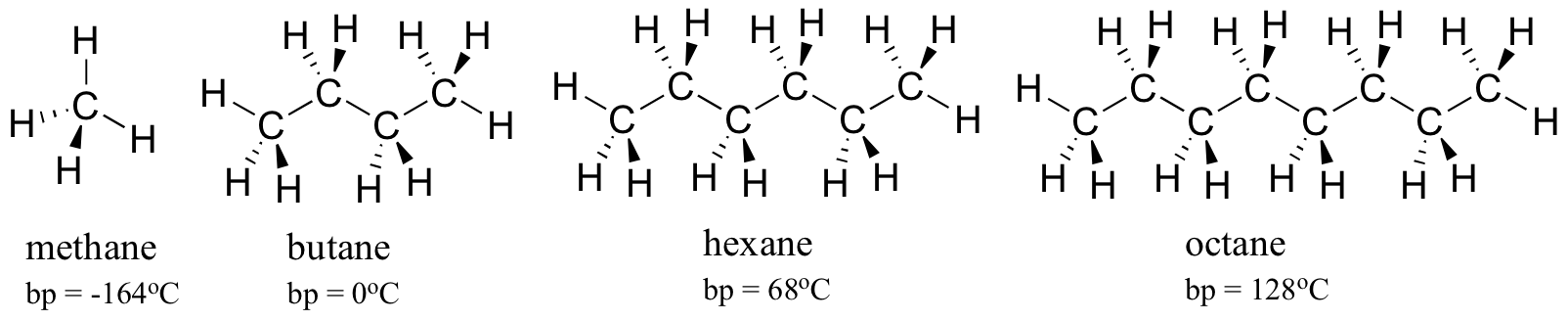
kuten arvata saattaa, molekyylien välisten vetysidosten ja dipoli-dipoli-vuorovaikutusten voimakkuus näkyy korkeammissa kiehumispisteissä. Katsokaa vain heksaanin (vain ei-polaarinen Lontoon dispersio-vuorovaikutus ), 3-heksanonin (dipoli-dipoli-vuorovaikutukset) ja 3-heksanolin (vetysidos) kehitystä.

erityisesti biologeja (ja aika lailla kaikkea muuta maailmankaikkeudessa elävää) kiinnostaa vedyn sidoksen vaikutus vedessä. Koska vesi pystyy muodostamaan tiiviitä molekyylien välisten vetysidosten verkostoja, se pysyy nestefaasissa jopa 100 OC: n lämpötilassa (hieman alempana korkealla). Maailma olisi tietenkin hyvin erilainen paikka, jos vesi kiehuisi 30 OC: ssa.
liikunta
1. Rakenteidensa perusteella fenoli, bentseeni, bentsaldehydi ja bentsoehappo luokitellaan alimmasta korkeimpaan kiehumispisteeseen.
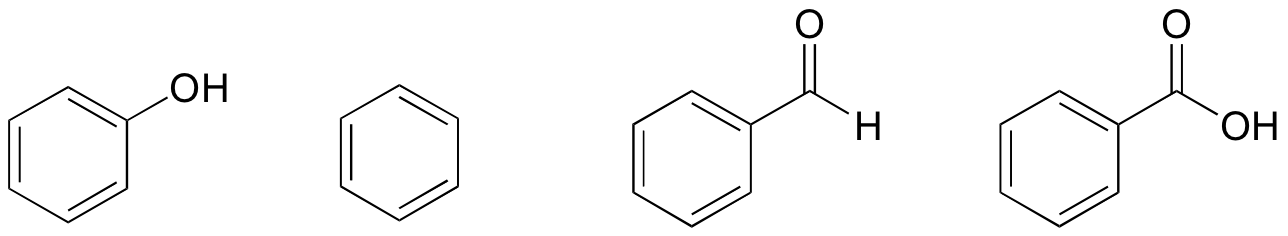
ratkaisu
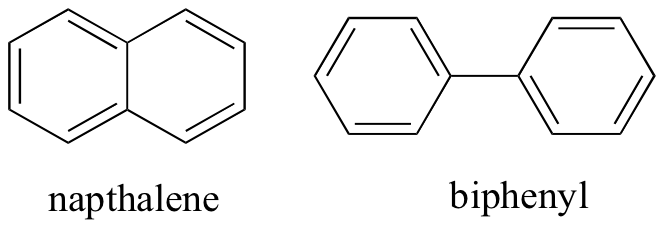
ajattelemalla ei-valenttisia molekyylien välisiä vuorovaikutuksia voimme ennustaa myös suhteellisia sulamispisteitä. Kaikki samat periaatteet pätevät: voimakkaammat molekyylien väliset vuorovaikutukset johtavat korkeampaan sulamispisteeseen. Ioniyhdisteillä on odotetusti yleensä hyvin korkeat sulamispisteet johtuen ioni-ioni-vuorovaikutusten voimakkuudesta (on kuitenkin olemassa joitakin ioniyhdisteitä, jotka ovat huoneenlämpötilassa nesteitä). Polaaristen ja erityisesti vetyä sitovien ryhmien esiintyminen orgaanisissa yhdisteissä johtaa yleensä korkeampiin sulamispisteisiin. Molekyylimuodolla ja molekyylin kyvyllä pakkautua tiiviisti kidehilaan on hyvin suuri vaikutus sulamispisteisiin. Aromaattisten yhdisteiden kuten naftaleenin ja bifenyylin tasainen muoto mahdollistaa niiden tehokkaan kasautumisen yhteen, ja siten aromaattisilla yhdisteillä on yleensä korkeammat sulamispisteet kuin alkaaneilla tai alkeeneilla, joiden molekyylipaino on samanlainen.
vertailemalla bentseenin ja tolueenin sulamispisteitä voidaan nähdä, että tolueenin ylimääräinen metyyliryhmä häiritsee molekyylin kykyä kasautua, jolloin molekyylien välisten Lontoon dispersiovoimien kumulatiivinen vahvuus vähenee.
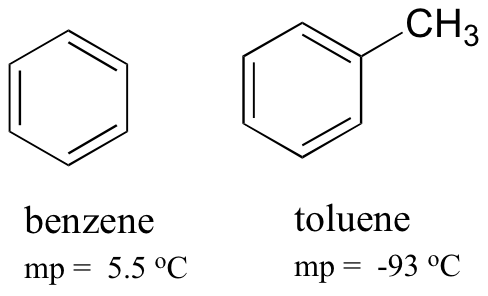
Huomaa myös, että tolueenin kiehumispiste on 111 oC, reilusti yli bentseenin kiehumispisteen (80 oC). Tässä tapauksessa kiehumispisteen trendin keskeinen tekijä on koko (tolueenissa on yksi hiili enemmän), kun taas sulamispisteen trendissä muodolla on paljon suurempi merkitys. Tämä on järkevää, kun otetaan huomioon, että sulaminen merkitsee molekyylien ’purkamista’ niiden järjestetystä kokoonpanosta, kun taas kiehuminen merkitsee yksinkertaisesti niiden erottamista niiden jo löyhästä (nestemäisestä) yhteydestä toisiinsa.
Jos olet luomulaboratoriokurssilla, olet ehkä jo oppinut, että epäpuhtaudet kiteisessä aineessa aiheuttavat sen, että havaittu sulamispiste on pienempi kuin puhtaassa näytteessä samasta aineesta. Tämä johtuu siitä, että epäpuhtaudet häiritsevät Kiteen järjestettyä pakkausjärjestelyä ja tekevät kumulatiivisista molekyylien välisistä vuorovaikutuksista heikompia.

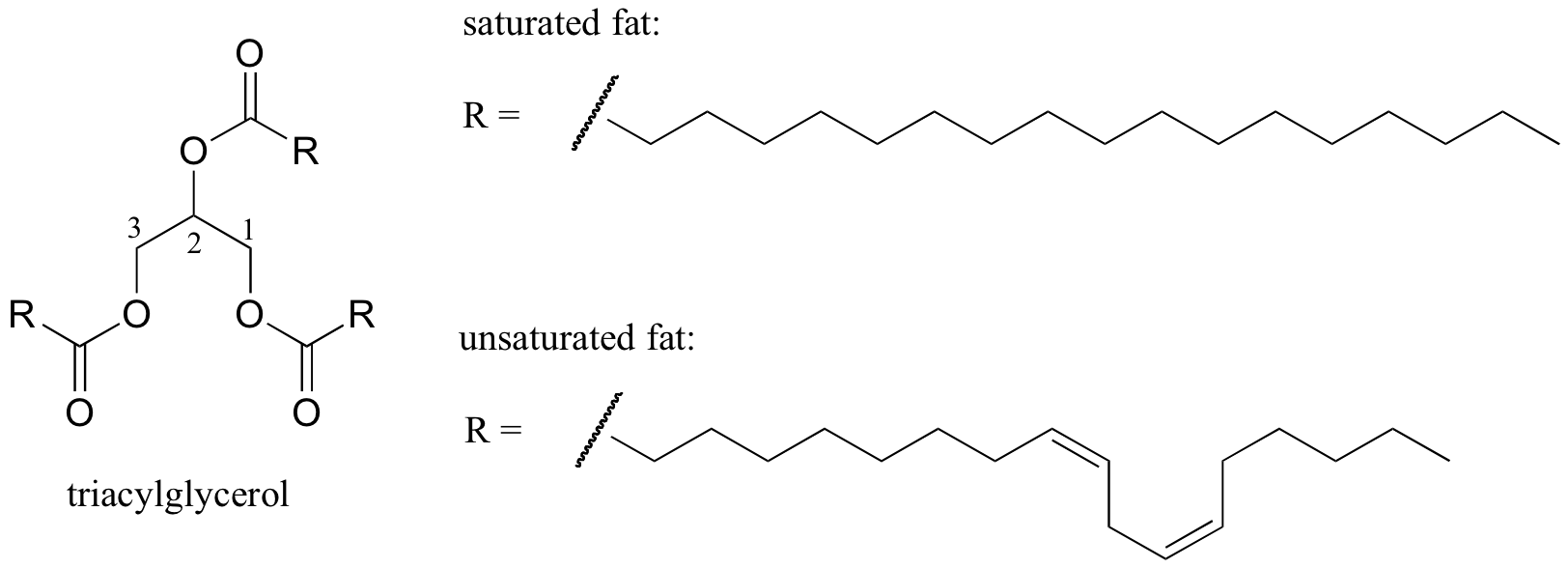
lipidirakenteiden sulamiskäyttäytyminen
mielenkiintoinen biologinen esimerkki molekyylirakenteen ja sulamispisteen välisestä suhteesta on havaittavissa oleva fysikaalinen ero eläinrasvojen, kuten voin tai ihran, jotka ovat huoneenlämmössä kiinteitä, ja kasviöljyjen, jotka ovat nestemäisiä. Sekä kiinteät rasvat että nestemäiset öljyt perustuvat triasyyliglyserolirakenteeseen, jossa kolme eripituista hydrofobista hiilivetyketjua on kiinnitetty glyserolin selkärankaan esterifunktionaalisen ryhmän kautta (vertaa tätä rakennetta kohdassa 2.4 B käsiteltyjen kalvolipidien rakenteeseen).
Interaktiivinen 3D-kuva tyydyttyneestä triasyyliglyserolista (biotooppi)
tyydyttynyt vs monotyydyttymätön rasvahappo (biotooppi)
kasviöljyissä hydrofobiset ketjut ovat tyydyttymättömiä, eli niissä on yksi tai useampi kaksoissidos. Kiinteä eläinrasva sen sijaan sisältää tyydyttyneitä hiilivetyketjuja, joissa ei ole kaksoissidoksia. Kasviöljyjen kaksoissidokset aiheuttavat sen, että hiilivetyketjut ovat jäykempiä ja ”taipuvat” kulmassa (muista, että kierto on rajoitettu kaksoissidosten ympärille), jolloin ne eivät pakene yhtä tiiviisti yhteen ja siten ne voidaan hajottaa (ts. sulanut) helpommin. Yllä olevassa kuvassa on monityydyttymätön rasvahappoketju (kaksi kaksoissidosta), ja voit klikata linkkiä nähdäksesi interaktiivisia kuvia tyydyttyneestä rasvahaposta verrattuna kertatyydyttymättömään rasvahappoon (yksi kaksoissidos).
liikunta
2. Järjestä seuraavat yhdisteet alenevan kiehumispisteen mukaiseen järjestykseen.

vastaus
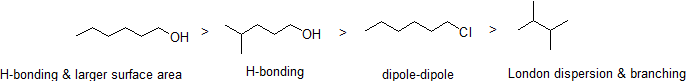
avustajat
- William Reusch, emeritusprofessori (Michigan State U.), Orgaanisen kemian virtuaalinen oppikirja
orgaanisen kemian biologinen painotus Tim Söderbergin (Minnesotan yliopisto, Morris)
Leave a Reply