2.11: intermolekylære kræfter og Relative kogepunkter (bp)
kogepunkter og smeltepunkter
de observerbare smelte-og kogepunkter for forskellige organiske molekyler giver en yderligere illustration af virkningerne af ikke-kovalente interaktioner. Det overordnede princip involveret er simpelt: jo stærkere de ikke-kovalente interaktioner mellem molekyler, jo mere energi kræves der i form af varme for at bryde dem fra hinanden. Højere smelte-og kogepunkter betyder stærkere ikke-kovalente intermolekylære kræfter.
overvej kogepunkterne for stadig større kulbrinter. Flere carbonatomer betyder et større overfladeareal muligt for hydrofob interaktion og dermed højere kogepunkter.
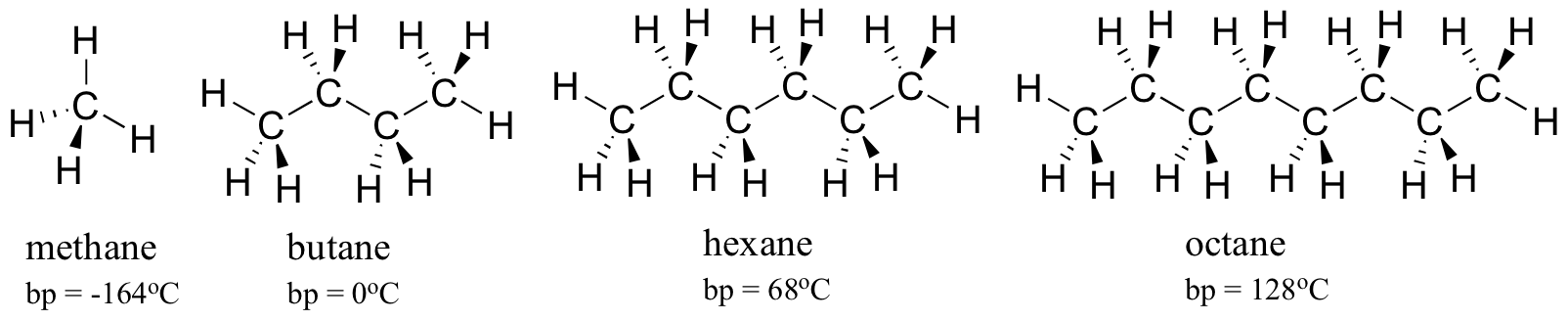
som du ville forvente, afspejles styrken af intermolekylær hydrogenbinding og dipol-dipol-interaktioner i højere kogepunkter. Bare se på tendensen for geksan (kun ikke-polære London-dispersionsinteraktioner), 3-geksanon (dipol-dipol-interaktioner) og 3-geksanol (hydrogenbinding).

af særlig interesse for biologer (og stort set alt andet, der lever i universet) er effekten af hydrogenbinding i vand. Fordi det er i stand til at danne tætte netværk af intermolekylære hydrogenbindinger, forbliver vand i væskefasen ved temperaturer op til 100 OC (lidt lavere i høj højde). Verden ville naturligvis være et meget andet sted, hvis vand kogt på 30 OC.
øvelse
1. Baseret på deres strukturer, rang phenol, bensene, bensaldehyd, og bensosyre i form af laveste til højeste kogepunkt.
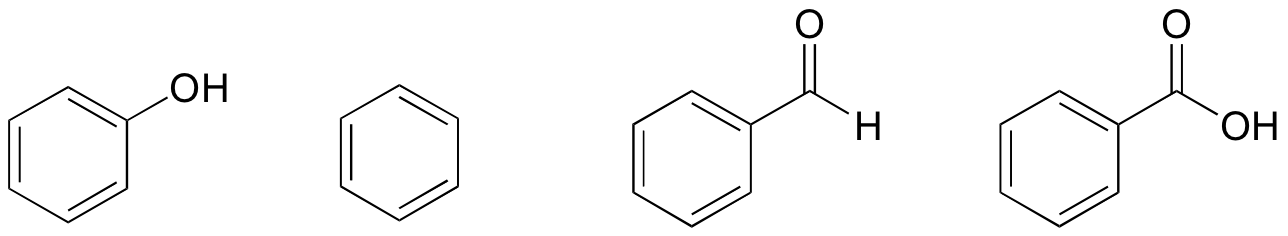
løsning
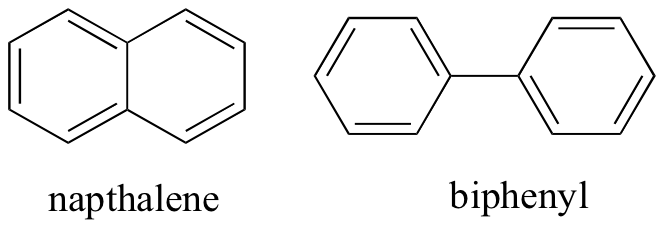
Ved at tænke på ikke-kovalente intermolekylære interaktioner kan vi også forudsige relative smeltepunkter. Alle de samme principper gælder: stærkere intermolekylære interaktioner resulterer i et højere smeltepunkt. Ioniske forbindelser har som forventet normalt meget høje smeltepunkter på grund af styrken af ion-ion-interaktioner (der er dog nogle ioniske forbindelser, der er væsker ved stuetemperatur). Tilstedeværelsen af polære og især hydrogenbindingsgrupper på organiske forbindelser fører generelt til højere smeltepunkter. Molekylær form og et molekyles evne til at pakke tæt ind i et krystalgitter har en meget stor effekt på smeltepunkter. Den flade form af aromatiske forbindelser, såsom napthalen og biphenyl, giver dem mulighed for at stable effektivt sammen, og aromater har således en tendens til at have højere smeltepunkter sammenlignet med alkaner eller alkener med lignende molekylvægte.
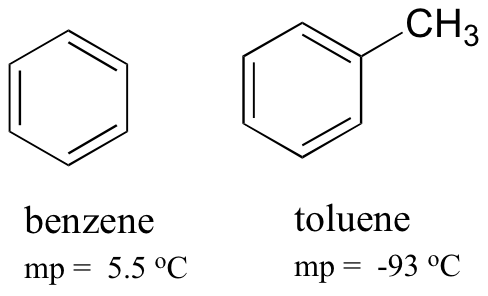
Bemærk også, at kogepunktet for toluen er 111 oC, et godt stykke over kogepunktet for toluen (80 oC). Nøglefaktoren for kogepunkttrenden i dette tilfælde er størrelse (toluen har endnu et kulstof), mens formen for smeltepunkttrenden spiller en meget vigtigere rolle. Dette giver mening, når man tænker på, at smeltning indebærer ‘udpakning’ af molekylerne fra deres ordnede array, mens kogning indebærer blot at adskille dem fra deres allerede løse (flydende) tilknytning til hinanden.
Hvis du tager et organisk laboratoriekursus, har du måske allerede lært, at urenheder i et krystallinsk stof vil medføre, at det observerede smeltepunkt er lavere sammenlignet med en ren prøve af det samme stof. Dette skyldes, at urenheder forstyrrer det bestilte pakningsarrangement af krystallen og gør de kumulative intermolekylære interaktioner svagere.

smelteadfærden af lipidstrukturer
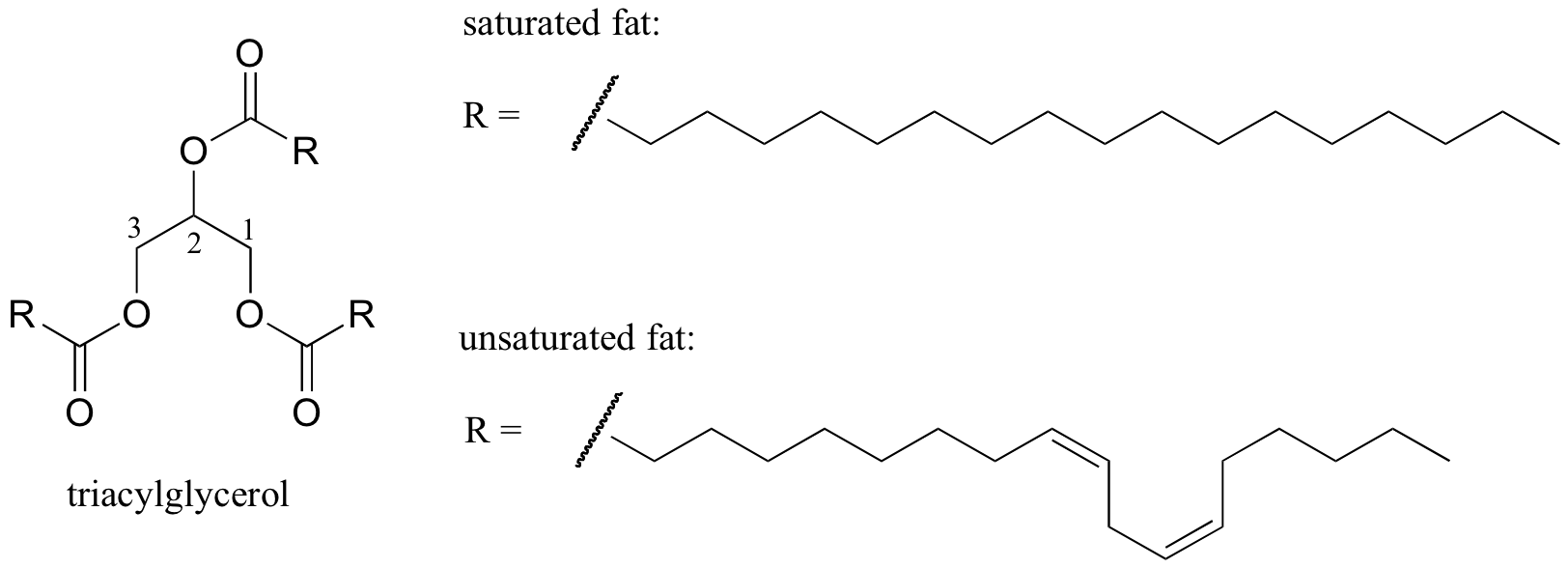
et interessant biologisk eksempel på forholdet mellem molekylær struktur og smeltepunkt tilvejebringes af den observerbare fysiske forskel mellem animalske fedtstoffer som smør eller svinefedt, som er faste ved stuetemperatur, og vegetabilske olier, som er flydende. Både faste fedtstoffer og flydende olier er baseret på en ‘triacylglycerol’ – struktur, hvor tre hydrofobe carbonhydridkæder af forskellig længde er bundet til en glycerol-rygrad gennem en esterfunktionel gruppe (sammenlign denne struktur med strukturen for membranlipiderne beskrevet i afsnit 2.4 B).
interaktivt 3D-billede af en mættet triacylglycerol (BioTopics)
mættet vs mono-umættet fedtsyre (BioTopics)
i vegetabilske olier er de hydrofobe kæder umættede, hvilket betyder, at de indeholder en eller flere dobbeltbindinger. Fast animalsk fedt indeholder derimod mættede carbonhydridkæder uden dobbeltbindinger. Dobbeltbindingerne i vegetabilske olier får disse carbonhydridkæder til at være mere stive og ‘bøjede’ i en vinkel (husk, at rotation er begrænset omkring dobbeltbindinger), med det resultat, at de ikke pakker sammen så tæt og således kan brydes fra hinanden (dvs. smeltet) lettere. Vist i figuren ovenfor er en flerumættet fedtsyrekæde (to dobbeltbindinger), og du kan klikke på linket for at se interaktive billeder af en mættet fedtsyre sammenlignet med en enumættet fedtsyre (en dobbeltbinding).
øvelse
2. Arranger følgende forbindelser i rækkefølge efter faldende kogepunkt.

svar
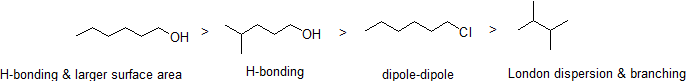
bidragydere
- Professor Emeritus (Michigan State U.), Virtuel lærebog om organisk kemi
organisk kemi med en biologisk vægt af Tim Soderberg (University of Minnesota, Morris)
Leave a Reply