2.11: Intermolecular Forces & Relative Boiling Points (bp)
Siedepunkte und Schmelzpunkte
Die beobachtbaren Schmelz- und Siedepunkte verschiedener organischer Moleküle veranschaulichen zusätzlich die Auswirkungen nichtkovalenter Wechselwirkungen. Das übergeordnete Prinzip ist einfach: Je stärker die nicht-kovalenten Wechselwirkungen zwischen Molekülen sind, desto mehr Energie wird in Form von Wärme benötigt, um sie auseinander zu brechen. Höhere Schmelz- und Siedepunkte bedeuten stärkere nichtkovalente intermolekulare Kräfte.
Betrachten Sie die Siedepunkte von immer größeren Kohlenwasserstoffen. Mehr Kohlenstoffe bedeuten eine größere Oberfläche für hydrophobe Wechselwirkung und damit höhere Siedepunkte.
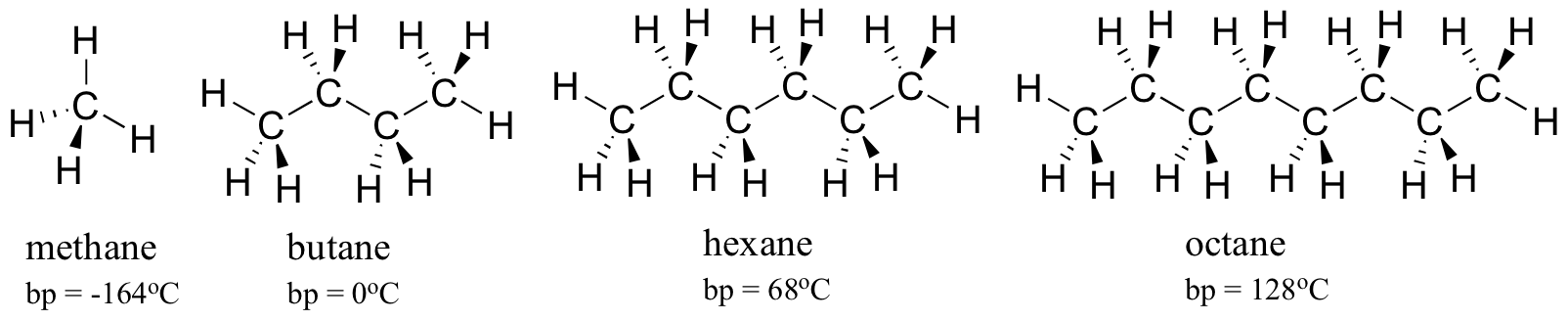
Wie zu erwarten, spiegelt sich die Stärke der intermolekularen Wasserstoffbindung und der Dipol-Dipol-Wechselwirkungen in höheren Siedepunkten wider. Schauen Sie sich nur den Trend für Hexan (nur unpolare Wasserstoffdispersionswechselwirkungen), 3-Hexanon (Dipol-Dipol-Wechselwirkungen) und 3-Hexanol (Wasserstoffbindung) an.

Von besonderem Interesse für Biologen (und so ziemlich alles andere, was im Universum lebt) ist der Effekt der Wasserstoffbindung in Wasser. Da es in der Lage ist, enge Netzwerke intermolekularer Wasserstoffbrückenbindungen zu bilden, verbleibt Wasser bei Temperaturen bis zu 100 OC in der flüssigen Phase (in großer Höhe etwas niedriger). Die Welt wäre offensichtlich ein ganz anderer Ort, wenn Wasser bei 30 OC kochen würde.
Übung
1. Basierend auf ihren Strukturen, Rang Phenol, Benzol, Benzaldehyd, und Benzoesäure in Bezug auf den niedrigsten bis höchsten Siedepunkt.
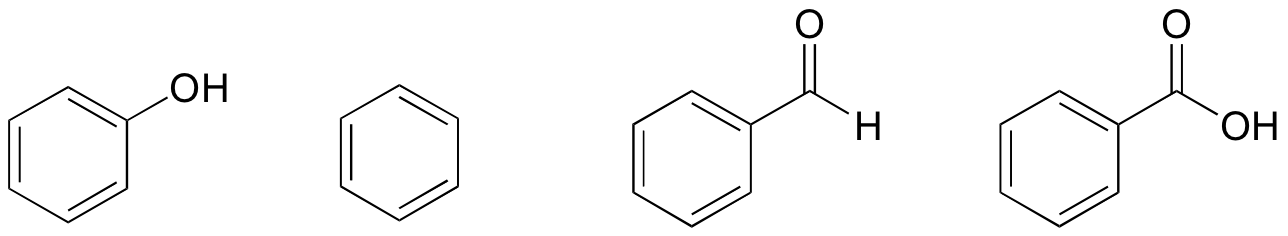
Lösung
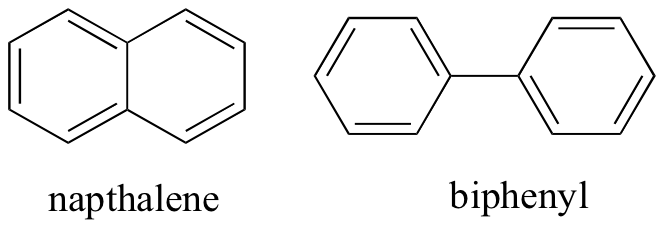
Wenn wir über nichtkovalente intermolekulare Wechselwirkungen nachdenken, können wir auch relative Schmelzpunkte vorhersagen. Es gelten die gleichen Prinzipien: Stärkere intermolekulare Wechselwirkungen führen zu einem höheren Schmelzpunkt. Ionische Verbindungen haben erwartungsgemäß aufgrund der Stärke der Ionen-Ionen-Wechselwirkungen normalerweise sehr hohe Schmelzpunkte (es gibt jedoch einige ionische Verbindungen, die bei Raumtemperatur flüssig sind). Die Anwesenheit von polaren und insbesondere wasserstoffbindenden Gruppen an organischen Verbindungen führt im Allgemeinen zu höheren Schmelzpunkten. Die Molekülform und die Fähigkeit eines Moleküls, sich fest in ein Kristallgitter zu packen, haben einen sehr großen Einfluss auf die Schmelzpunkte. Die flache Form von aromatischen Verbindungen wie Naptalin und Biphenyl ermöglicht es ihnen, effizient miteinander zu stapeln, und daher neigen Aromaten dazu, höhere Schmelzpunkte im Vergleich zu Alkanen oder Alkenen mit ähnlichen Molekulargewichten zu haben.
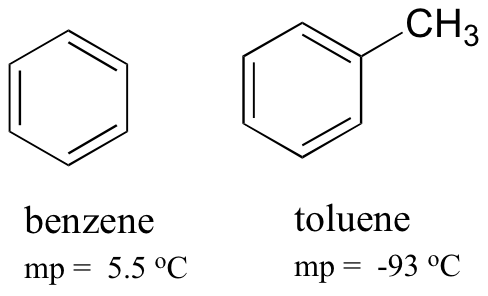
Wenn Sie die Schmelzpunkte von Benzol und Toluol vergleichen, können Sie sehen, dass die zusätzliche Methylgruppe auf Toluol die Stapelfähigkeit des Moleküls stört und somit die kumulative Stärke der intermolekularen London-Dispersionskräfte verringert.
Wenn Sie an einem organischen Laborkurs teilnehmen, haben Sie möglicherweise bereits gelernt, dass Verunreinigungen in einer kristallinen Substanz dazu führen, dass der beobachtete Schmelzpunkt im Vergleich zu einer reinen Probe derselben Substanz niedriger ist. Dies liegt daran, dass Verunreinigungen die geordnete Packungsanordnung des Kristalls stören und die kumulativen intermolekularen Wechselwirkungen schwächer machen.

Das Schmelzverhalten von Lipidstrukturen
Ein interessantes biologisches Beispiel für die Beziehung zwischen molekularer Struktur und Schmelzpunkt liefert der beobachtbare physikalische Unterschied zwischen tierischen Fetten wie Butter oder Schmalz, die bei Raumtemperatur fest sind, und pflanzlichen Ölen, die flüssig sind. Sowohl feste Fette als auch flüssige Öle basieren auf einer Triacylglycerinstruktur, bei der drei hydrophobe Kohlenwasserstoffketten unterschiedlicher Länge über eine esterfunktionelle Gruppe an ein Glycerinrückgrat gebunden sind (vergleichen Sie diese Struktur mit der der in Abschnitt 2.4B diskutierten Membranlipide).
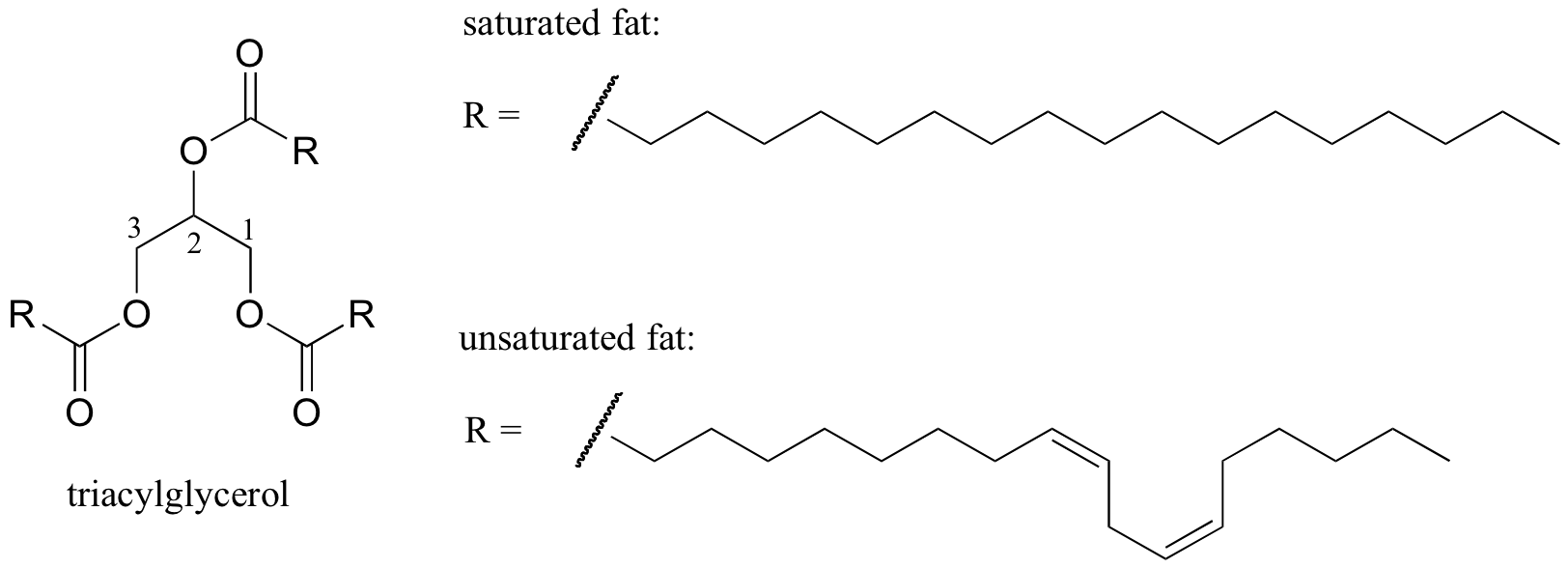
Interaktives 3D-Bild eines gesättigten Triacylglycerins (BioTopics)
Gesättigte vs einfach ungesättigte Fettsäure (BioTopics)
In Pflanzenölen sind die hydrophoben Ketten ungesättigt, was bedeutet, dass sie eine oder mehrere Doppelbindungen enthalten. Festes tierisches Fett hingegen enthält gesättigte Kohlenwasserstoffketten ohne Doppelbindungen. Die Doppelbindungen in Pflanzenölen bewirken, dass diese Kohlenwasserstoffketten steifer und in einem Winkel ‚gebogen‘ werden (denken Sie daran, dass die Rotation um Doppelbindungen eingeschränkt ist), mit dem Ergebnis, dass sie nicht so eng zusammenpacken und somit auseinander gebrochen werden können (dh. geschmolzen) leichter. Sie können auf den Link klicken, um interaktive Bilder einer gesättigten Fettsäure im Vergleich zu einer einfach ungesättigten Fettsäure (eine Doppelbindung) anzuzeigen.
Übung
2. Ordnen Sie die folgenden Verbindungen in der Reihenfolge des abnehmenden Siedepunkts an.

Antwort
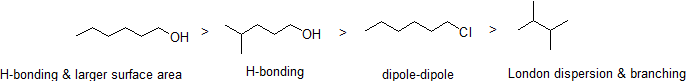
Mitwirkende
- William Reusch, emeritierter Professor (Michigan State U.), Virtuelles Lehrbuch der Organischen Chemie
Organische Chemie mit biologischem Schwerpunkt von Tim Soderberg (University of Minnesota, Morris)
Leave a Reply