2.11: Forces intermoléculaires et Points d’Ébullition Relatifs (bp)
Points d’ébullition et points de fusion
Les points de fusion et d’ébullition observables de différentes molécules organiques fournissent une illustration supplémentaire des effets des interactions non covalentes. Le principe global impliqué est simple: plus les interactions non covalentes entre les molécules sont fortes, plus il faut d’énergie, sous forme de chaleur, pour les séparer. Des points de fusion et d’ébullition plus élevés signifient des forces intermoléculaires non covalentes plus fortes.
Considérez les points d’ébullition des hydrocarbures de plus en plus gros. Plus de carbones signifie une plus grande surface possible pour l’interaction hydrophobe, et donc des points d’ébullition plus élevés.
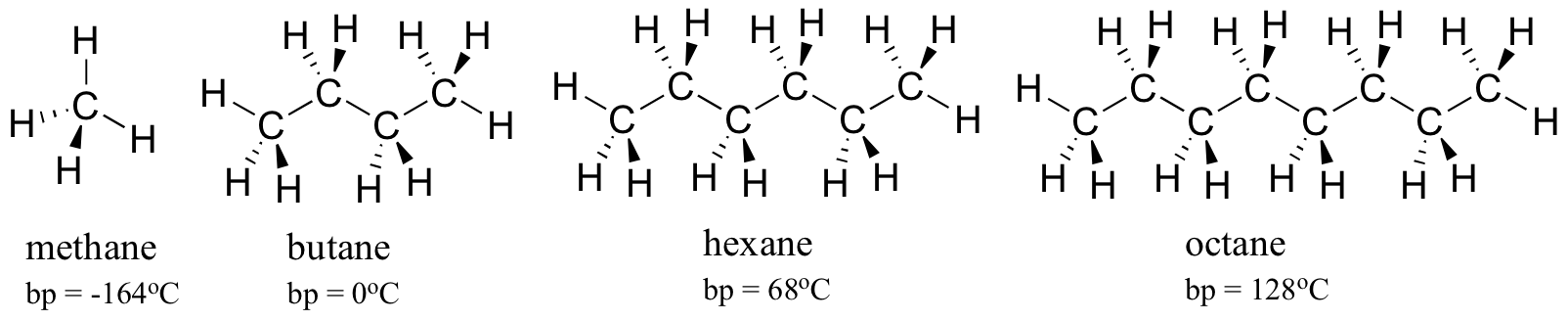
Comme on pouvait s’y attendre, la force de la liaison hydrogène intermoléculaire et des interactions dipôle-dipôle se reflète dans des points d’ébullition plus élevés. Il suffit de regarder la tendance pour l’hexane (interactions de dispersion non polaire London uniquement), la 3-hexanone (interactions dipôle-dipôle) et le 3-hexanol (liaison hydrogène).

D’un intérêt particulier pour les biologistes (et à peu près tout ce qui est vivant dans l’univers) est l’effet de la liaison hydrogène dans l’eau. Parce qu’elle est capable de former des réseaux étroits de liaisons hydrogène intermoléculaires, l’eau reste en phase liquide à des températures allant jusqu’à 100 OC (légèrement plus basses à haute altitude). Le monde serait évidemment un endroit très différent si l’eau bouillait à 30 OC.
Exercice
1. Sur la base de leurs structures, classez le phénol, le benzène, le benzaldéhyde et l’acide benzoïque en termes de point d’ébullition le plus bas au plus élevé.
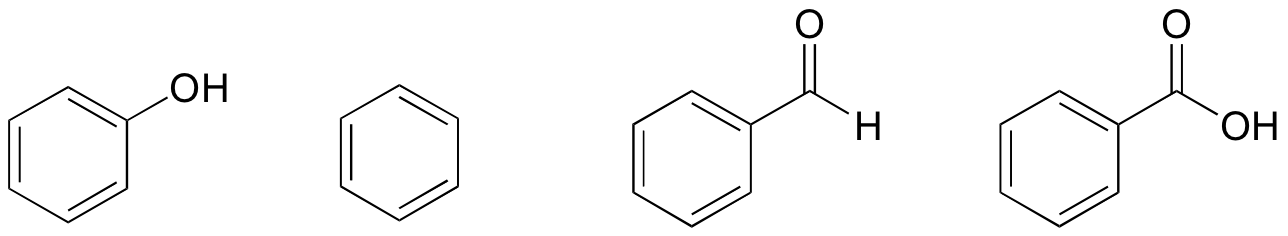
Solution
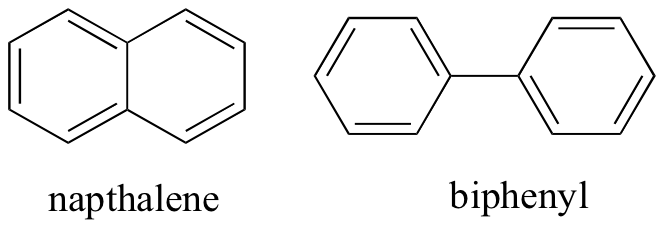
En pensant aux interactions intermoléculaires non covalentes, nous pouvons également prédire les points de fusion relatifs. Tous les mêmes principes s’appliquent: des interactions intermoléculaires plus fortes entraînent un point de fusion plus élevé. Les composés ioniques, comme prévu, ont généralement des points de fusion très élevés en raison de la force des interactions ion-ion (certains composés ioniques sont cependant des liquides à température ambiante). La présence de groupes polaires et notamment de liaison hydrogène sur les composés organiques conduit généralement à des points de fusion plus élevés. La forme moléculaire et la capacité d’une molécule à s’emballer étroitement dans un réseau cristallin ont un effet très important sur les points de fusion. La forme plate des composés aromatiques tels que le naptalène et le biphényle leur permet de s’empiler efficacement, et les aromatiques ont donc tendance à avoir des points de fusion plus élevés que les alcanes ou les alcènes de poids moléculaires similaires.
En comparant les points de fusion du benzène et du toluène, vous pouvez voir que le groupe méthyle supplémentaire sur le toluène perturbe la capacité de la molécule à s’empiler, diminuant ainsi la force cumulative des forces de dispersion intermoléculaires de London.
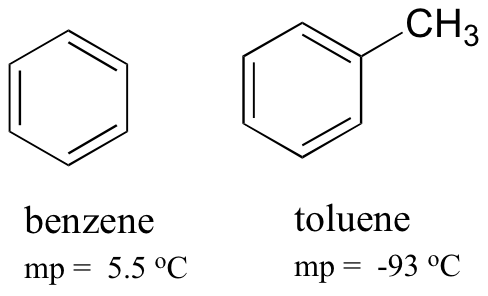
Notez également que le point d’ébullition du toluène est de 111 oC, bien au-dessus du point d’ébullition du benzène (80 oC). Le facteur clé de la tendance du point d’ébullition dans ce cas est la taille (le toluène a un carbone de plus), alors que pour la tendance du point de fusion, la forme joue un rôle beaucoup plus important. Cela a du sens lorsque l’on considère que la fusion implique de « déballer » les molécules de leur réseau ordonné, tandis que l’ébullition implique simplement de les séparer de leur association déjà lâche (liquide) les unes avec les autres.
Si vous suivez un cours de laboratoire organique, vous avez peut-être déjà appris que les impuretés dans une substance cristalline entraîneront une baisse du point de fusion observé par rapport à un échantillon pur de la même substance. En effet, les impuretés perturbent la disposition ordonnée de l’emballage du cristal et affaiblissent les interactions intermoléculaires cumulatives.

Le comportement de fusion des structures lipidiques
Un exemple biologique intéressant de la relation entre la structure moléculaire et le point de fusion est fourni par la différence physique observable entre les graisses animales comme le beurre ou le saindoux, qui sont solides à température ambiante, et les huiles végétales, qui sont liquides. Les graisses solides et les huiles liquides sont basées sur une structure de « triacylglycérol », où trois chaînes hydrocarbonées hydrophobes de longueur variable sont attachées à un squelette de glycérol par l’intermédiaire d’un groupe fonctionnel ester (comparer cette structure à celle des lipides membranaires discutés dans la section 2.4B).
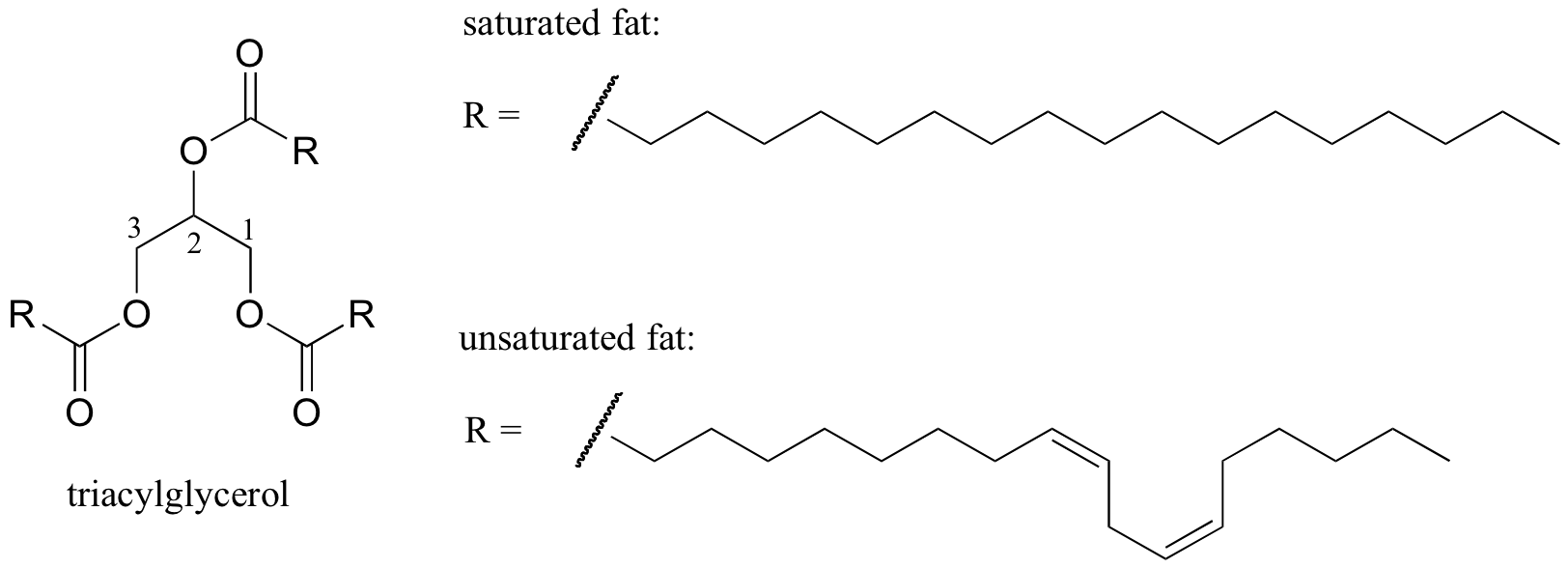
Image 3D interactive d’un triacylglycérol saturé (BioTopics)
Acide gras saturé vs mono-insaturé (BioTopics)
Dans les huiles végétales, les chaînes hydrophobes sont insaturées, c’est-à-dire qu’elles contiennent une ou plusieurs doubles liaisons. La graisse animale solide, en revanche, contient des chaînes hydrocarbonées saturées, sans doubles liaisons. Les doubles liaisons dans les huiles végétales rendent ces chaînes hydrocarbonées plus rigides et « pliées » en angle (rappelez-vous que la rotation est limitée autour des doubles liaisons), de sorte qu’elles ne s’emboîtent pas aussi étroitement et peuvent donc être brisées (ie. fondu) plus facilement. La figure ci-dessus montre une chaîne d’acides gras polyinsaturés (deux doubles liaisons), et vous pouvez cliquer sur le lien pour voir des images interactives d’un acide gras saturé comparé à un acide gras monoinsaturé (une double liaison).
Exercice
2. Disposer les composés suivants par ordre décroissant de point d’ébullition.

Réponse
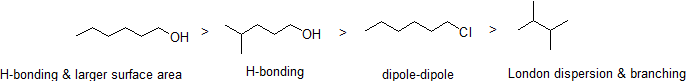
Contributeurs
- William Reusch, Professeur émérite (Michigan State U.), Manuel Virtuel de Chimie Organique
Chimie organique avec un accent biologique par Tim Soderberg (Université du Minnesota, Morris)
Leave a Reply