2.11: Intermolekylære Krefter og Relative Kokepunkter (bp)
Kokepunkter og smeltepunkter
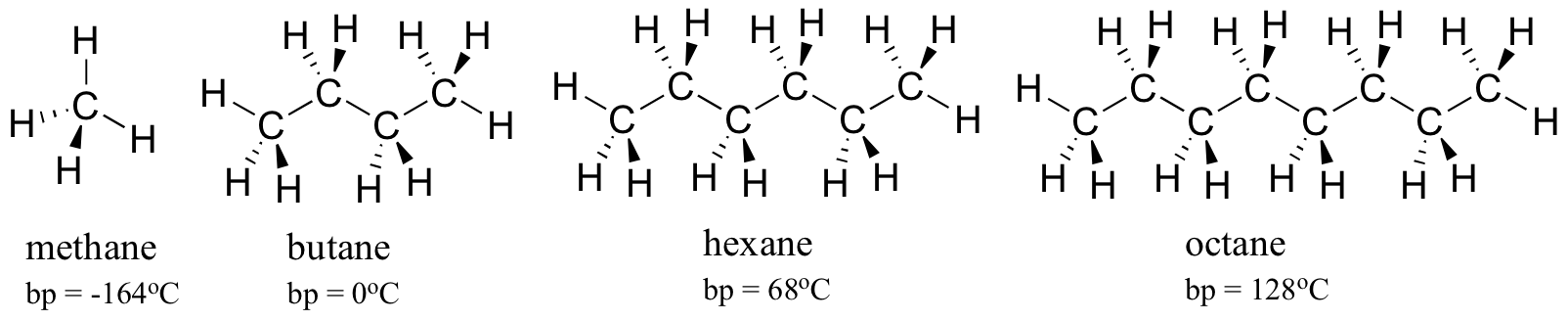
de observerbare smelte-og kokepunktene for forskjellige organiske molekyler gir en ytterligere illustrasjon av effektene av ikke-kovalente interaksjoner. Det overordnede prinsippet er enkelt: jo sterkere de ikke-kovalente interaksjonene mellom molekyler, jo mer energi som kreves, i form av varme, for å bryte dem fra hverandre. Høyere smelte-og kokepunkter betyr sterkere ikke-kovalente intermolekylære krefter.
Vurder kokepunktene for stadig større hydrokarboner. Flere karboner betyr et større overflateareal mulig for hydrofob interaksjon, og dermed høyere kokepunkter.
som du forventer, reflekteres styrken av intermolekylær hydrogenbinding og dipol-dipol-interaksjoner i høyere kokepunkter. Bare se på trenden for heksan (bare Ikke-polare london-dispersjonsinteraksjoner), 3-heksanon (dipol-dipol-interaksjoner) og 3-heksanol (hydrogenbinding).

av spesiell interesse for biologer (og stort sett alt annet som lever i universet) er effekten av hydrogenbinding i vann. Fordi det er i stand til å danne tette nettverk av intermolekylære hydrogenbindinger, forblir vann i væskefasen ved temperaturer opp til 100 OC, (litt lavere i høy høyde). Verden ville åpenbart være et helt annet sted hvis vann kokt på 30 OC.
Trening
1. Basert på deres strukturer, rang fenol, benzen, benzaldehyd, og benzosyre i form av laveste til høyeste kokepunkt.
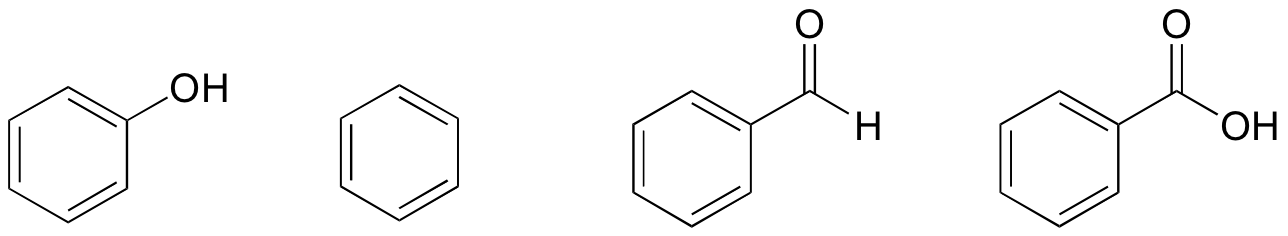
Løsning
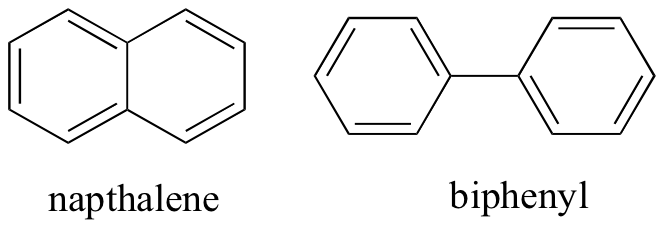
ved å tenke på ikke-kovalente intermolekylære interaksjoner, kan vi også forutsi relative smeltepunkter. Alle de samme prinsippene gjelder: sterkere intermolekylære interaksjoner resulterer i et høyere smeltepunkt. Ioniske forbindelser, som forventet, har vanligvis svært høye smeltepunkter på grunn av styrken av ion-ion-interaksjoner (det er imidlertid noen ioniske forbindelser som er væsker ved romtemperatur). Tilstedeværelsen av polare og spesielt hydrogenbindende grupper på organiske forbindelser fører vanligvis til høyere smeltepunkter. Molekylær form, og et molekyls evne til å pakke tett inn i et krystallgitter, har en meget stor effekt på smeltepunkter. Den flate formen av aromatiske forbindelser som naptalen og bifenyl gjør at de kan stable sammen effektivt, og dermed har aromater en tendens til å ha høyere smeltepunkter sammenlignet med alkaner eller alkener med lignende molekylvekter.
Sammenligning av smeltepunktene av benzen og toluen, kan du se at den ekstra metylgruppen på toluen forstyrrer molekylets evne til å stable, og dermed redusere den kumulative styrken av Intermolekylære london dispersjonskrefter.
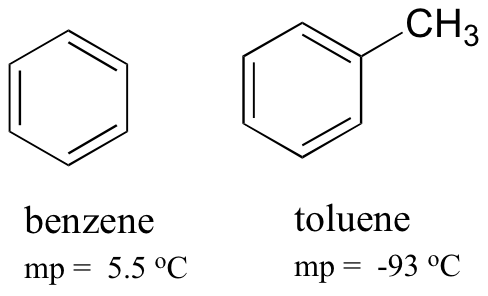
merk også at kokepunktet for toluen er 111 oC, godt over kokepunktet for benzen (80 oC). Nøkkelfaktoren for kokepunktstrenden i dette tilfellet er størrelse (toluen har enda et karbon), mens for smeltepunktstrenden spiller form en mye viktigere rolle. Dette er fornuftig når du vurderer at smelting innebærer å pakke ut molekylene fra deres bestilte array, mens koking innebærer å bare skille dem fra deres allerede løse (flytende) tilknytning til hverandre.
hvis du tar et organisk laboratoriekurs, har du kanskje allerede lært at urenheter i et krystallinsk stoff vil føre til at det observerte smeltepunktet blir lavere sammenlignet med en ren prøve av samme stoff. Dette skyldes at urenheter forstyrrer det bestilte pakkearrangementet av krystallet, og gjør de kumulative intermolekylære interaksjonene svakere.

smelteadferden til lipidstrukturer
et interessant biologisk eksempel på forholdet mellom molekylær struktur og smeltepunkt er gitt av den observerbare fysiske forskjellen mellom animalsk fett som smør eller smult, som er fast ved romtemperatur, og vegetabilske oljer, som er flytende. Både fast fett og flytende oljer er basert på en ‘triacylglycerol’ struktur, hvor tre hydrofobe hydrokarbonkjeder av varierende lengde er festet til en glyserol ryggrad gjennom en ester funksjonell gruppe(sammenlign denne strukturen til den av membranlipidene diskutert i avsnitt 2.4 B).
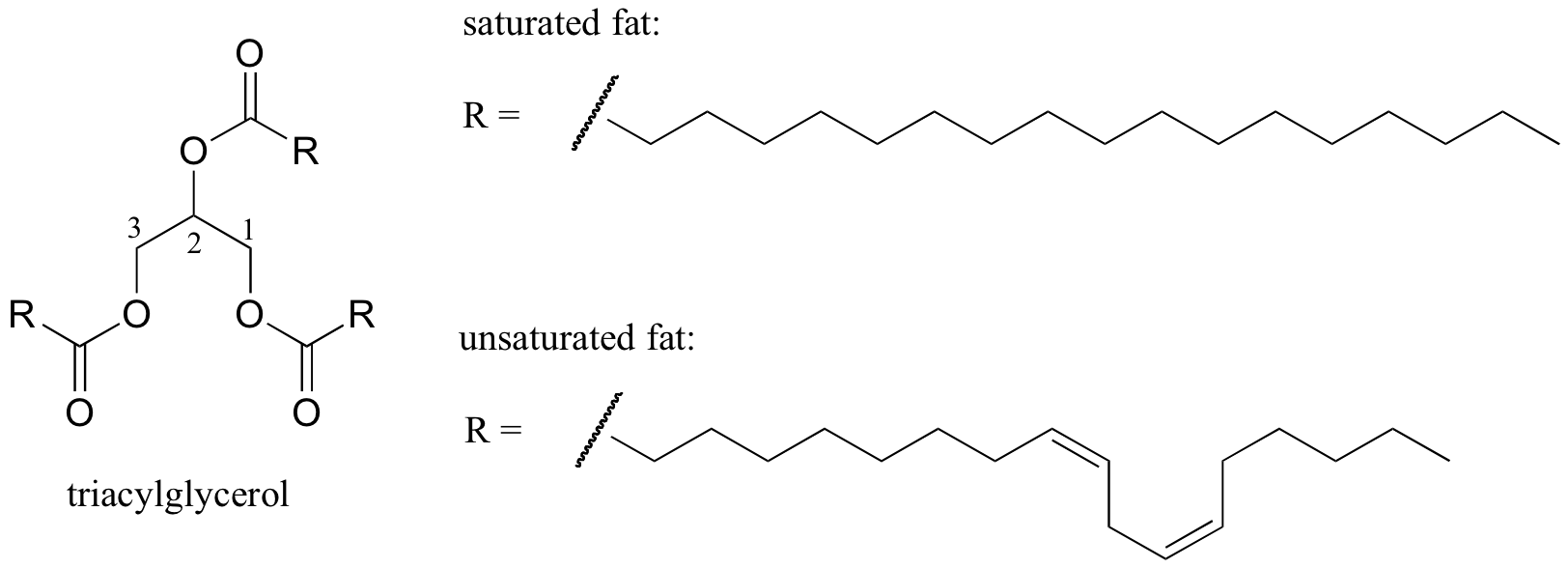
Mettet vs monoumettet fettsyre (BioTopics)
i vegetabilske oljer er de hydrofobe kjedene umettede, noe som betyr at de inneholder en eller flere dobbeltbindinger. Fast animalsk fett inneholder derimot mettede hydrokarbonkjeder, uten dobbeltbindinger. Dobbeltbindingene i vegetabilske oljer gjør at disse hydrokarbonkjedene blir stivere og’ bøyd ‘ i en vinkel (husk at rotasjonen er begrenset rundt dobbeltbindinger), med det resultat at de ikke pakker sammen så tett, og dermed kan brytes fra hverandre (dvs. smeltet) lettere. Vist i figuren over er en flerumettet fettsyrekjede (to dobbeltbindinger), og du kan klikke på linken for å se interaktive bilder av en mettet fettsyre sammenlignet med en enumettet fettsyre (en dobbeltbinding).
Øvelse
2. Ordne følgende forbindelser i rekkefølge av avtagende kokepunkt.

Svar
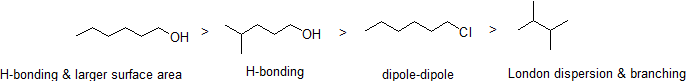
Bidragsytere
- William Reusch, Professor Emeritus (Michigan State U.), Virtuell Lærebok Av Organisk Kjemi
Organisk Kjemi Med En Biologisk Vekt Av Tim Soderberg (University Of Minnesota, Morris)
Leave a Reply