2.11:分子間力と相対沸点(bp)
沸点と融点
異なる有機分子の観測可能な融点と沸点は、非共有相互作用の効果 分子間の非共有結合相互作用が強ければ強いほど、それらを分解するために熱の形で必要とされるより多くのエネルギーが必要になります。 より高い融点および沸点は、より強い非共有分子間力を意味する。
ますます大きな炭化水素の沸点を考えてみましょう。 より多くの炭素は、疎水性相互作用のために可能なより大きな表面積を意味し、したがってより高い沸点を意味する。 p>
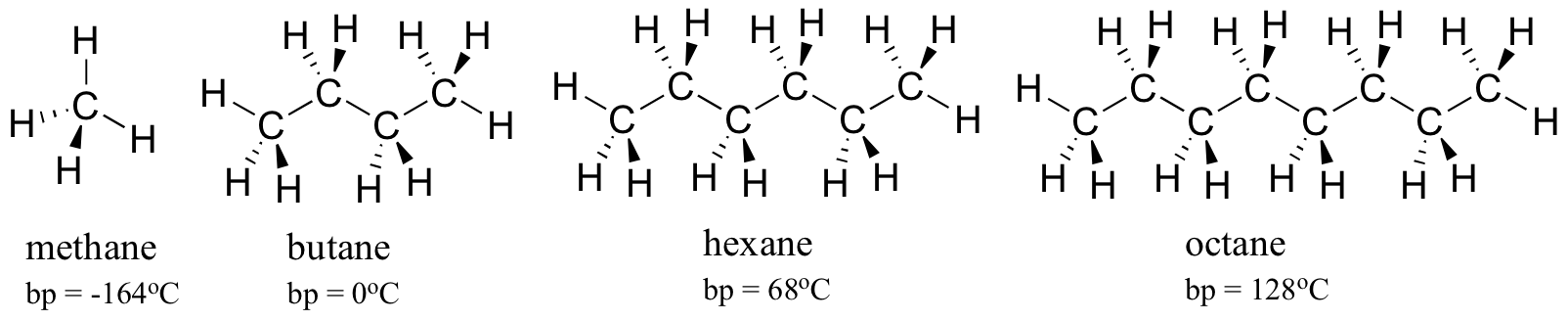
ご想像のとおり、分子間水素結合と双極子-双極子相互作用の強さは、より高い沸点に反映されています。 ヘキサン(非極性ロンドン分散相互作用のみ)、3-ヘキサノン(双極子-双極子相互作用)、および3-ヘキサノール(水素結合)の傾向を見てください。 p>

生物学者(そして宇宙で生きている他のほとんどのもの)にとって特に興味深いのは、水中の水素結合の効果です。 それは分子間水素結合の緊密なネットワークを形成することができるので、水は100℃までの温度で液相に残る(高高度ではわずかに低い)。 水が30OCで沸騰した場合、世界は明らかに非常に異なる場所になります。
練習
1. それらの構造に基づいて、フェノール、ベンゼン、ベンズアルデヒド、および安息香酸を最低沸点から最高沸点の点でランク付けする。 p>
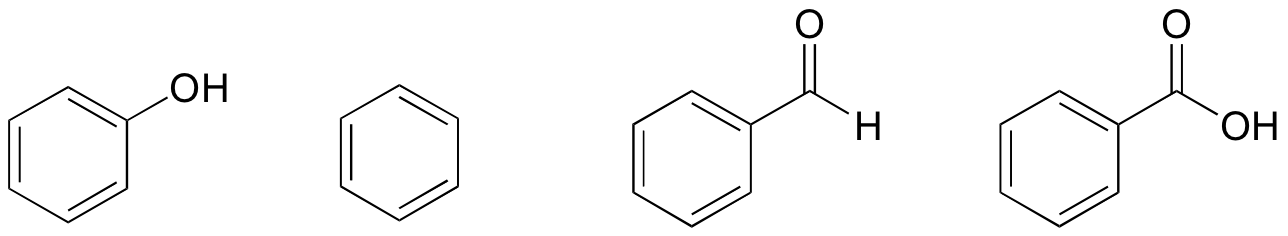
ソリューション
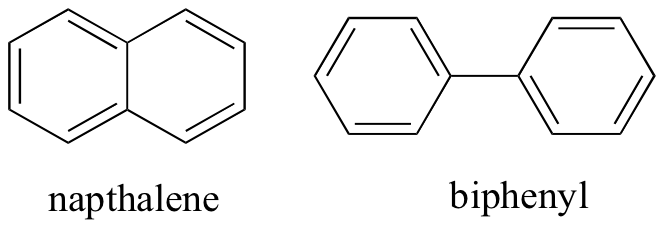
非共有分子間相互作用を考えることによって、我々はまた、相対的な融点を予測することができます。 同じ原理のすべてが適用されます:より強い分子間相互作用は、より高い融点をもたらす。 イオン性化合物は、予想されるように、通常、イオン-イオン相互作用の強さのために非常に高い融点を有する(ただし、室温で液体であるイオン性化合物 有機化合物上の極性基、特に水素結合基の存在は、一般に、より高い融点をもたらす。 分子の形状、および結晶格子にしっかりとパックする分子の能力は、融点に非常に大きな影響を与えます。 ナプタレンやビフェニルなどの芳香族化合物の平坦な形状は、それらが効率的に積み重ねることを可能にし、したがって芳香族化合物は、同様の分子量 p>
ベンゼンとトルエンの融点を比較すると、トルエン上の余分なメチル基が分子のスタック能力を破壊し、分子間分散力の累積強度を低下させることがわかる。p>
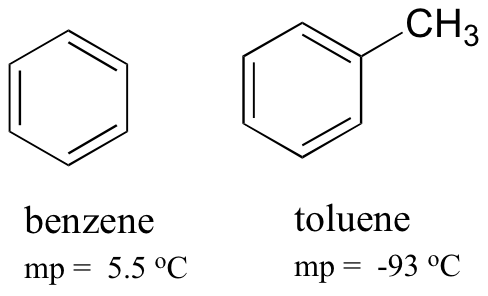
トルエンの沸点は111℃であり、ベンゼンの沸点(80℃)をはるかに上回っていることにも注意してください。 この場合の沸点傾向の重要な要因はサイズ(トルエンはもう一つの炭素を有する)であるが、融点傾向の場合、形状ははるかに重要な役割を果たす。 これは、溶融がそれらの秩序配列から分子を「開梱」することを含むと考えるときに理にかなっていますが、沸騰は単にそれらを既に緩んでいる(液体)
有機ラボコースを受講している場合は、結晶性物質中の不純物が、同じ物質の純粋なサンプルと比較して観測された融点が低くなることをすでに学 これは、不純物が結晶の規則的なパッキング配列を破壊し、累積分子間相互作用を弱くするためです。 p>

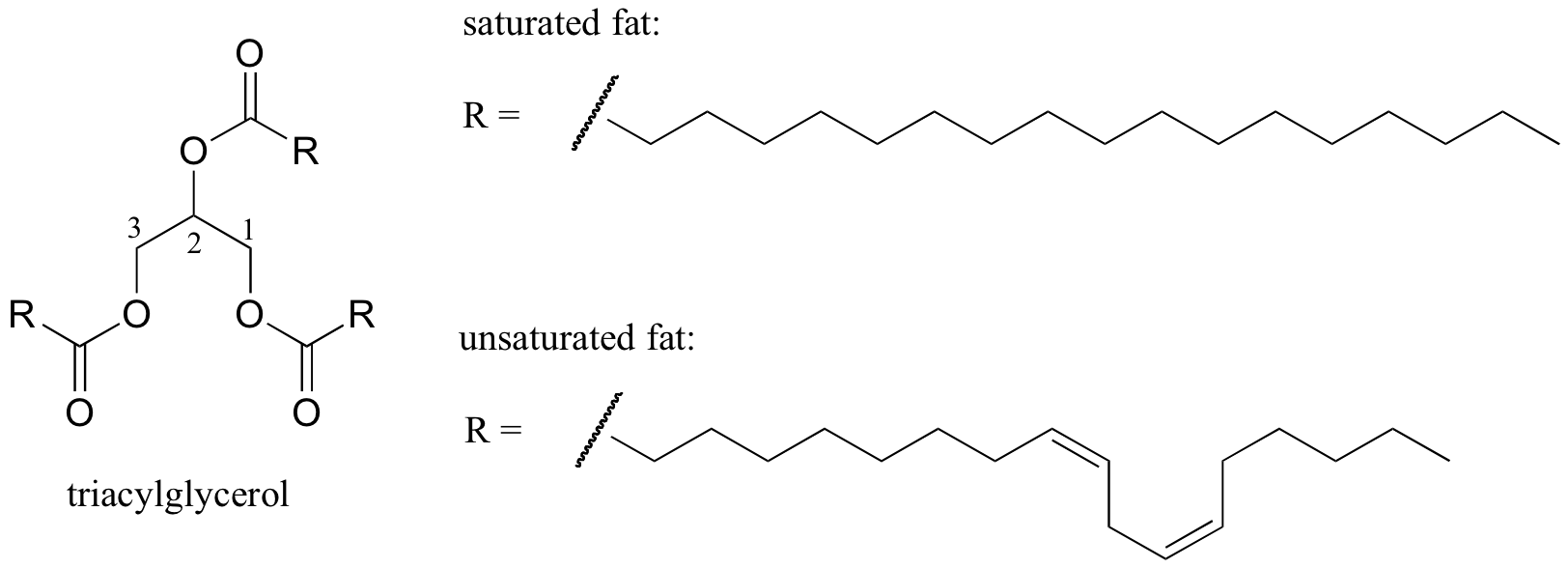
脂質構造の融解挙動
分子構造と融点の関係の興味深い生物学的例は、室温で固体であるバターやラードのような動物性脂肪と液体である植物油との間の観測可能な物理的な違いによって提供される。 固体脂肪と液体油の両方が”トリアシルグリセロール”構造に基づいており、長さの異なる三つの疎水性炭化水素鎖がエステル官能基を介してグリセロール骨格に結合している(この構造をセクション2.4Bで議論されている膜脂質の構造と比較してください)。p>
飽和トリアシルグリセロール(BioTopics)のインタラクティブな3D画像
飽和vsモノ不飽和脂肪酸(BioTopics)
植物油では、疎水性鎖は不飽和であり、一つ以上の二重 対照的に、固体動物性脂肪は、二重結合を伴わない飽和炭化水素鎖を含む。 植物油中の二重結合は、それらの炭化水素鎖をより剛性にし、角度で「曲がって」(回転が二重結合の周りに制限されていることを覚えておいてください)、 溶けた)より容易に。 上の図に示すのは多価不飽和脂肪酸鎖(2つの二重結合)であり、リンクをクリックすると、一価不飽和脂肪酸(1つの二重結合)と比較した飽和脂肪酸のイP>
練習
2. 以下の化合物を沸点の低い順に並べる。

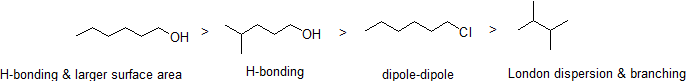
貢献者
- William Reusch,名誉教授(ミシガン州U.
Tim Soderberg(ミネソタ大学、モリス)による生物学的重点を置いた有機化学
Leave a Reply