Nátrium-klorid tulajdonságok / / a nátrium-klorid jó az Ön számára?
cikk témák
a nátrium-klorid egy ionos vegyület, amelynek kémiai képlete NaCl. Színtelen köbös kristály vagy finom kristályos por, sós ízű.
a megjelenés fehér kristály, forrása elsősorban tengervíz, amely az asztali só fő összetevője. Vízben, glicerinben oldódik, enyhén oldódik etanolban (alkoholban), folyékony ammóniában, koncentrált sósavban oldhatatlan. A tisztátalan nátrium-klorid a levegőben lebomlik.
a stabilitás viszonylag jó, vizes oldata semleges. Iparilag az elektrolitikus úton telített nátrium-klorid-oldat módszerét általában hidrogén, klór és marószóda (nátrium-hidroxid) és más vegyi termékek (általában klóralkáli ipar) előállítására használják.
használható oresmeltingben (nátrium-klorid kristályok elektrolitikus olvadása aktívmetál-nátrium előállításához), orvosilag fiziológiás sóoldat konfigurálására, valamint a mindennapi életbenízesítéshez használható.
Összetett Bevezetés
Alap Információk
angol név: nátrium-klorid
angol alias: nátrium-hidroklorid; Sodiumchloride
CAS-szám: 7647-14-5
Molekuláris képlet: NaCl
molekulatömegű: 58.44280
Pontos tömeg: 57.95860
Biztonsági Adatok
vámkódex: 2501002000
Veszély kategória kód: R36; R22
Biztonsági utasítások: S24 / 25-S26
a Veszélyes áruk jel: Xi.
Fizikai tulajdonságai Nátrium-klorid
Megjelenítés tulajdonságai: színtelen kristály orwhite por
Sűrűség: 2.165g/cm3 (25 ° c)
vízoldhatóság: 360 g/L (25 ºC)
stabilitás: Normál szállítási és kezelési feltételek mellett stabil.
tárolási feltételek: alacsony hőmérséklet, szellőztetett ésszáraz raktárban
gőznyomás: 1 mm Hg (865 ° C)
Olvadáspont: 801 ° c
forráspont: 1465 ℃
a nátrium-klorid fehér szagtalan kristályos por. Mp 801 deg.] C, forráspontja 1465 fok.] C, enyhén oldódik etanolban, propanolban, bután, bután, és miután a plazma elegyedik, vízben oldódik, a víz oldhatósága 35,9 g (szobahőmérséklet).
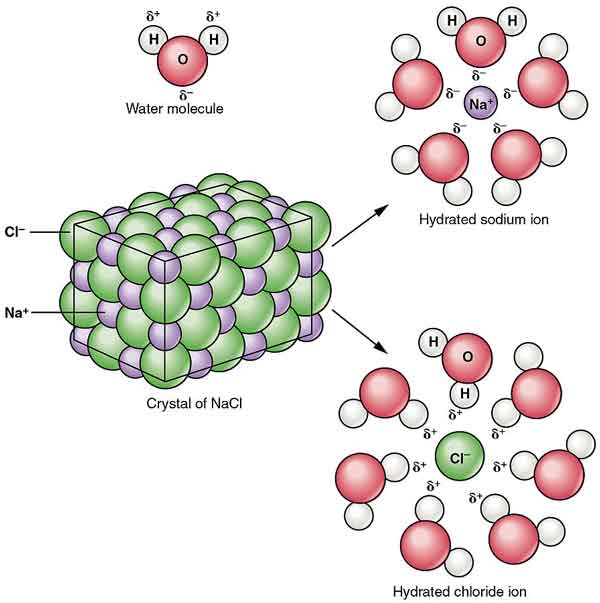
NaCl az alkoholban kolloidokat képez. Vízben való oldhatóságát a hidrogén-klorid jelenléte csökkenti, koncentrált sósavban pedig szinte oldhatatlan.
nátrium-klorid kémiai tulajdonságai
a nátrium-klorid kristályai sztereó szimmetriát alkotnak. Kristályszerkezetében a nagyobb kloridionok alkotják a kocka legsűrűbb csomagolását, a kisebb nátriumionok pedig kitöltik a kloridionok közötti oktaéderes rést. Each ion is surrounded by six other ions. This structure is also found in many other compounds, called sodium chloride type structure or stone salt structure.

1. Preparationof sodium metal by electrolytic melting of sodium chloride
2NaCl(molten) = 2Na + Cl2
2. Electrolytic saltwater
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
3. React withsilver nitrate
NaCl + AgNO3 = NaNO3 + AgCl
Ionic equation:
Cl– + Ag+ = AgCl
(Which is theessence CI – property)
4. Reaction withconcentrated sulfuric acid (laboratory hydrogen chloride)
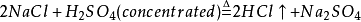

( Concentrated behalfconcentrated, Excess Representative excess)
5.NaCl test
A: a salétromsav oldatához cseppenként kloridot adtunk ezüst-nitrát savanyított oldatához, fehér csapadék (kicsapódott ezüst– klorid) keletkezik, bizonyított CI -.
B: merítsen egy kis mennyiségű oldatot platina huzallal, majd tegye rá egy alkohollámpára, hogy égjen. A láng sárga, és bizonyítható, hogy Na+ – t tartalmaz.
C: az interferencia kiküszöbölése érdekében az eredeti vizsgálati oldatot telített bárium-hidroxiddal lehet hozzáadni, amíg nyilvánvalóan lúgos. Ebben az időben a legtöbb kationok és anionok, mint a PO43− as− AsO43-kicsapódik. a vizsgált oldatba bevitt
Ba2+ – t ammónium-karbonáttal el kell távolítani, végül az ammónium-sót égetéssel el kell távolítani. Miután a maradékot vízzel kimosták, az oldatot HAc-val savanyítottuk, az uranil-cink-acetát reagenst pedig az 1: 8 cseppek számának megfelelően adtuk hozzá,a cső falát üvegrúddal dörzsöltük. Ha citromsárga kristályok alakultak ki, Na + volt jelen.
nátrium-klorid
ipari módszer
tengervízzel sómezőkbe juttatva (átlagosan 2.4% – os nátrium-klorid) és napon szárítva, kristályosításra koncentrálva, nyers termék előállításához. A tengervizet gőzzel is fel lehet melegíteni, homokszűrővel szűrni, ioncserélő membrán elektrodialízissel sűríteni, hogy sóoldatot kapjunk (160-180g / L nátrium-kloridot tartalmaz).
a halo gipszet párolgással kicsapjuk, és a kapott klórt centrifugáljuk. Több mint 95% nátrium (2% nedvesség) szárítható a megszerzéshezközös só. A szikes só és a sós tó sós lében is lehet használni, mint rawmaterials és szárított a nap, hogy nyers sót.
amikor föld alatti sóoldatot és kútsót használnak nyersanyagként, három – vagy négyhatásos párolgással elegyednek, kristályokat kicsapnak, és centrifugálják, hogy hozzájussanak.
Laboratóriumi módszer
A nyers sós vízben, hogy távolítsa el a nem oldódó szennyeződések, valamint finomított készítmények, például nátrium-hidroxid, vagy a nátrium-karbonát ki, hogy oldódó szennyeződések, mint a SO42-, Ca2+, illetve a Mg2+ válik, kicsapódik, szűrt, hogy távolítsa el, majd végül a tisztított A pH kiigazításra került, hogy 7 sósavval, a megoldás az volt, koncentrált, hogy szerezzen tiszta nátrium-klorid, kristályok.
a készítménymódszer a laboratóriumban egyenlő mennyiségű sósavat összekeverninátrium-hidroxid, hogy nátrium-klorid-oldatot képezzen. Az oldatot ezután nátrium-klorid kristályok előállítására használták fel. A fő reakció:
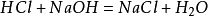
ezenkívül a nátrium-klorid nátrium-kloridot is termel,ha a klórgáz meggyulladkörnyezetében. Kémiai egyenlete:
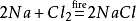
mire használják a nátrium-kloridot
ipar
1. Amikor elektrolitikus nátrium-klorid-oldat keletkezik, hidrogén és klórgáz keletkezik. A klórgáz számos felhasználási területe van a vegyiparban, és használható polivinil-klorid, peszticidek, sósav stb.
2. Nátrium-fém előállítása Dangs módszerrel: nátrium-fém előállítása sodium-klorid és kalcium-klorid keverék elektrolitikus olvasztásával. A kalcium-kloridot alacsonyabb fluxusként használjáka nátrium-klorid olvadáspontja 700 ° C alatt. a kalcium kevésbé reduktív, mint a nátrium, és nem vezet be szennyeződéseket.
3. A nátrium-klorid számos biológiai szempontból szükségesreakciókat. Például a molekuláris biológia különböző oldatképleteiaz experimensek nátrium-kloridot tartalmaznak, a bakteriális tenyészet legtöbbje pedig nátrium-kloridot tartalmaz. Ez is a nyersanyag a termelésbensoda hamu ammónia-alkáli módszerrel.
4. A szervetlen és szerves iparágakat a marószóda, a klorát, a hipoklorit, a fehérítőpor, a hűtőrendszerek hűtőközegei, a szerves szintézis alapanyagai és a sózószerek előállításához használják nyersanyagként. Az acélipart hőkezelő szerként használják. A magas hőmérsékletű hőforrást kálium-kloriddal, bárium-kloriddal stb., amely lehet használni, mint egy fűtőközeg, hogy fenntartsák a hőmérséklet között 820-960 ° C Ezen kívül azt is használják üveg, festékek, kohászat, valamint más iparágakban.
5. Az analitikai reagenseket fluor-és szilikatetrace-analízis reagensként használják.
6. Szénsavas hamutermelés A Hou alkáli módszerével: ez a második lépés: az első lépésben elkészített ammónium-hidrogén-karbonát oldatot nátrium-klorid oldattal összekeverjük, hogy nátrium-hidrogén-karbonátot és ammónium-kloridot kapjunk 10°C-on.
Élelmiszeripar
az élelmiszeripart és a halászatot sózásra, valamint fűszerezésre és finomított asztali sóra szolgáló nyersanyagokra használják.
só hozzáadása a szakácsételekhez eltávolíthatja a nyersanyagok szagait, és növelheti az ízét, ami a sófreshness hatása. “Enyhén íztelen, sós, íztelen” azt jelentia megfelelő mennyiségű só felhasználható egyedi funkcióinak kifejtésére.
Medical
a nátrium-klorid nagyon fontos az élet számáraa föld. A legtöbb biológiai szövet több sót tartalmaz. A nátrium koncentrációja a vérben közvetlenül kapcsolódik a szabályozáshoza testfolyadékok biztonságos szintje. Az idegimpulzusok vezetésea signal átalakulást nátriumionok is szabályozzák.
A 0,9% nátrium-kloridot tartalmazó vizet szalinnak nevezikmert ugyanolyan ozmotikus nyomással rendelkezik, mint a plazma. A normál sóoldat aa testfolyadék helyettesítője. Széles körben használják a kezelés megelőzésébena kiszáradás, valamint az intravénás injekció kezelésébenés a hipovolémiás sokk megelőzésére.
más főemlősöktől eltérően az emberek izzadás révén nagy mennyiségű nátrium-kloridot választanak ki.
a nátrium-klorid nélkülözhetetlenhumánok. A felnőtteknél található nátriumionok teljes mennyisége körülbelül 60 g, amelynek 80% – a extracelluláris folyadékban van, azaz plazmában és intercellularfluidban. A klorid elsősorban extracelluláris folyadékban is jelen van. A nátrium-és kloridionok élettani funkciói:
(1) az extracelluláris folyadék ozmotikus nyomásának fenntartása.
(2) részt vesz a sav-bázis egyensúly szabályozásában a szervezetben.
(3) a klorid részt vesz aa gyomorsav a szervezetben. Ezenkívül a nátrium-klorid is szerepet játszikaz idegek és izmok normális ingerlékenységének fenntartása.
mezőgazdaság
vizes oldata magkiválasztásra használható. A NaCl oldat a fajok igényei szerint van konfigurálva, sűrűsége nagyobb, mint a vízé. A magokat betesszük az oldatba, teljesen lebeg,és teljesen elsüllyed.
egyéb
A Szingapúri technológiai Kutatóintézet által kiadott új eredmények szerint a nátrium-klorid jelentősen megnövelheti a merevlemezek kapacitását. Pontosabban, a létezika hagyományos merevlemez véletlenszerűen kiosztott mágneses lemez tárolást használtechnológia, amely csak 0,5 TB / négyzet hüvelyk adatsűrűséget érhet el.
az új technológia előnyös a sodiumklorid segítségével. Az új, nagyfelbontású litográfiai faktor technológiával az adatok rendezettebbek lesznek, elérve a 3-at.3TB négyzetcentiméterenként anélkül, hogy szükségesbonyolult berendezésfrissítésekhez. Az 1TB merevlemez használata ezzela technológia elérheti a 6TB kapacitást lemezek hozzáadása nélkül.
- ammónia Formula || miért mérgező az ammónia || ammónia mérgezés
- miért fontos az ózonréteg || ózonréteg kimerülése
- mi az oldat koncentrációja | hogyan befolyásolja a reakciót
- miért fontos a szénciklus/hogyan működik
- Haloalkanes és Haloarenes NCERT Solutions | /Haloalkane Structure
- szén-dioxid ciklus és képlet | /hogyan keletkezik a szén-dioxid
Leave a Reply