Vlastnosti chloridu sodného / / je pro vás chlorid sodný dobrý?
Témata Článku
chlorid Sodný je iontová sloučenina s chemickým vzorcem NaCl. Je to bezbarvý krychlový krystal nebo jemný krystalický prášek a chutná slaně.
vzhled je bílý krystal a jeho zdrojem je hlavně mořská voda, která je hlavní složkou stolní soli. Rozpustný ve vodě, glycerin, mírně rozpustný v ethanolu( alkohol), kapalný amoniak, nerozpustný v koncentrované kyselině chlorovodíkové. Nečistý chlorid sodný je ve vzduchu rozpustný.
stabilita je relativně dobrá a její vodný roztok je neutrální. Průmyslově se metoda elektrolyticky nasyceného roztoku chloridu sodného obecně používá k výrobě vodíku, chloru a hydroxidu sodného (hydroxidu sodného) a dalších chemických produktů (běžně nazývaných Chlor-alkalický průmysl).
To může být použit v oresmelting (elektrolytické tání chloridu sodného krystaly vyrábět activemetal sodný), klinicky používá ke konfiguraci fyziologického roztoku, a denní lifecan být použit pro koření.
Sloučenina Úvod
Základní Informace
anglický název: chlorid sodný
angličtina alias: chlorid hydrochlorid; Sodiumchloride
číslo CAS: 7647-14-5
Molekulární vzorec: NaCl
Molekulová hmotnost: 58.44280
Přesná hmotnost: 57.95860
Bezpečnostní Informace
Celní kód: 2501002000
kategorie nebezpečnosti kód: R36; R22
Bezpečnostní pokyny: S24 / 25-S26
Nebezpečné zboží označení: Xi
Fyzikální vlastnosti chloridu Sodného
Vzhled a vlastnosti: bezbarvý krystal orwhite prášek
Hustota: 2.165g / cm3 (25 ° c)
rozpustnost ve vodě: 360 g / L (25 ºC)
stabilita: Stabilní za normálních přepravních a manipulačních podmínek.
podmínky Skladování: nízká teplota, větrané asuché ve skladu,
tlak Páry: 1 mm Hg (865 ° C)
bod Tání: 801 ° C
bod Varu: 1465 ℃
chlorid Sodný je bílý krystalický prášek bez zápachu. Mp 801 deg.] C, Bod varu 1465 deg.] C, mírně rozpustný v ethanolu, propanolu, butan, butan, a poté, co se plazma stává mísitelný rozpustný ve vodě, rozpustnost ve vodě z 35.9 g (pokojová teplota).
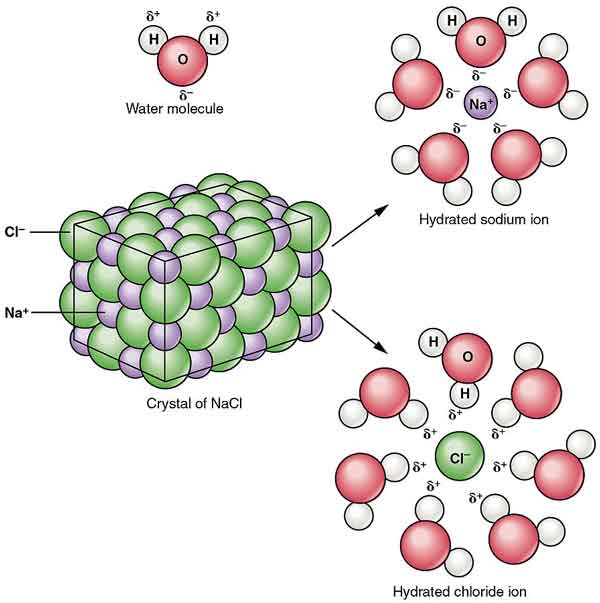
NaCl je rozptýlen v alkoholu tvořit koloidy. Jeho rozpustnost ve vodě je snížena přítomností chlorovodíku a je téměř nerozpustná v koncentrované kyselině chlorovodíkové.
chemické vlastnosti chloridu sodného
krystaly chloridu sodného tvoří stereofonní symetrii. Ve své krystalové struktuře tvoří větší chloridové ionty nejhustší balení v krychli a menší sodíkové ionty vyplňují oktaedrální mezeru mezi chloridovými ionty. Each ion is surrounded by six other ions. This structure is also found in many other compounds, called sodium chloride type structure or stone salt structure.

1. Preparationof sodium metal by electrolytic melting of sodium chloride
2NaCl(molten) = 2Na + Cl2
2. Electrolytic saltwater
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
3. React withsilver nitrate
NaCl + AgNO3 = NaNO3 + AgCl
Ionic equation:
Cl– + Ag+ = AgCl
(Which is theessence CI – property)
4. Reaction withconcentrated sulfuric acid (laboratory hydrogen chloride)
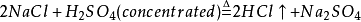

( Concentrated behalfconcentrated, Excess Representative excess)
5.NaCl test
A: sodný byl přidán po kapkách k roztoku kyseliny dusičné měl okyseleného roztoku dusičnanu stříbrného, bílá sraženina (vysrážený chlorid stříbrný) je generován, dokázal CI– .
B: ponořte malé množství roztoku platinovým drátem a položte jej na alkoholovou lampu, aby hořel. Plamen je žlutý a lze prokázat, že obsahuje Na+.
C: aby se eliminovala interference, může být původní zkušební roztok přidán nasyceným hydroxidem barnatým, dokud není zjevně alkalický. V tuto chvíli bude vysrážena většina kationtů a aniontů, jako je PO43− a AsO43.
Ba2 + zavedený do zkušebního roztoku by měl být odstraněn uhličitanem amonným a nakonec amonná sůl by měla být odstraněna spálením. Po zbytek se vyplaví vodou, roztok se okyselí s HAc, a uranylu octan zinečnatý činidla bylo přidáno podle počtu kapek 1: 8, a trubka byla zeď třel s skleněnou tyčinkou. Pokud byly vytvořeny citronově žluté krystaly, byl přítomen Na+.
Příprava chloridu sodného
průmyslová metoda
zavedená do solných polí mořskou vodou (průměr 2.4% chlorid sodný) a suší se na slunci, koncentruje se za krystalizace, aby se získal surový produkt. Mořská voda může být také ohřívána párou, filtrována pískovým filtrem a koncentrována iontoměničovou membránovou elektrodialýzou za účelem získání solanky (obsahující chlorid sodný 160-180g / L).
halo sádra se vysráží odpařením a získaný chlorje odstředěn. Více než 95% sodíku (2% vlhkosti) lze vysušit, aby se získaloběžná sůl. Rock salt a salt lake slaném nálevu mohou být také použity jako surovin a sušené na slunci, jak získat syrové sůl.
Když podzemní slané vodě a dobře soli se používají jako suroviny, se areconcentrated tři – nebo čtyři-efekt odpařování, krystaly vysráží,a odstředí získat.
Laboratorní metoda
surová sůl se rozpustí ve vodě k odstranění nerozpustných nečistot, a rafinované přípravky, jako jsou hydroxid sodný a uhličitan sodný jsou přidány, aby se rozpustné nečistoty, jako SO42-, Ca2+ a Mg2+ se stal sraženin, filtrován odstranit, a konečně očištěn s pH byla upravena na 7 pomocí kyseliny chlorovodíkové a roztok se koncentruje na získání čisté krystaly chloridu sodného.
přípravekmetoda v laboratoři je smíchat stejné množství kyseliny chlorovodíkovéhydroxid sodný za vzniku roztoku chloridu sodného. Roztok byl poté destilován za účelem získání krystalů chloridu sodného. Hlavní reakce:
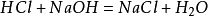
kromě toho,chlorid sodný bude také produkovat hydroxid sodný při vznícení v prostředí plynného chlóru. Jeho chemické rovnice je:
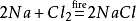
co se Chlorid Sodný používá se pro
Průmysl
1. Při elektrolytickém roztoku chloridu sodného jeelektrolyzován, vytvoří se plynný vodík a chlor. Plynný chlor má širokou škálu aplikací v chemickém průmyslu a může být použit tosyntetizujte polyvinylchlorid, pesticidy, kyselinu chlorovodíkovou atd.
2. Příprava kovu sodného metodou Dangs: Příprava kovu sodného elektrolytickým roztavením směsi chloridu sodného a chloridu vápenatého. Chlorid vápenatý se používá jako tavidlo ke sníženíteplota tání chloridu sodného pod 700 ° C. vápník je méněreduktivní než sodík a nezavádí nečistoty.
3. Chlorid sodný je nezbytný pro mnoho biologickýchreakce. Například různé vzorce řešení v molekulární biologiiexperimenty obsahují chlorid sodný a většina bakteriálních kultivačních médiíobsahuje chlorid sodný. Je také surovinou při výroběsoda popel metodou amoniaku a alkalických látek.
4. Anorganický a organický průmysl se používá jako surovina pro výrobu hydroxidu sodného, chlornanu, chlornanu, bělícího prášku, chladiv pro chladicí systémy, surovin pro organickou syntézu a solení. Ocelářský průmysl se používá jako činidlo tepelného zpracování. Vysokoteplotní zdroj tepla se používá k vytvoření solné lázně s chloridem draselným, chloridem barnatým atd., který může být použit jako topné médium pro udržení teploty mezi 820-960 ° C. Kromě toho se používá také ve skle, barvivech, metalurgii a dalších průmyslových odvětvích.
5. Analytická činidla se používají jako činidla pro analýzu fluoru a křemičitanu.
6. Výroba uhličitanu sodného alkalickou metodou Hou: druhý krok: roztok hydrogenuhličitanu amonného připravený v prvním kroku se smísí s roztokem chloridu sodného za vzniku hydrogenuhličitanu sodného a chloridu amonného při 10°C.
potravinářský průmysl
potravinářský průmysl a rybolov se používajísolení, stejně jako suroviny pro koření a rafinovanou stolní sůl.
přidání soli do nádobí na vaření může odstranit některé zápachyz surovin a zvýšit chuť, což je účinek soličerstvost. „Mírně bez chuti, slané a bez chuti“ to znamenáprávné množství soli může být použito k uplatnění jeho jedinečných funkcí.
lékařský
chlorid sodný je pro život na zemi velmi důležitý. Většina biologických tkání obsahuje více solí. Akoncentrace sodíku v krvi přímo souvisí s regulacíbezpečná hladina tělesných tekutin. Vedení nervových impulzů způsobenýchsignální konverze je také regulována sodnými ionty.
voda obsahující 0,9% chloridu sodného se nazývá salinprotože má stejný osmotický tlak jako plazma. Normální fyziologický roztok jehlavní náhrada tělesné tekutiny. Je široce používán při léčbě a prevencidehydratace a používá se také při léčbě intravenózní injekcea prevenci hypovolemického šoku.
na rozdíl od jiných primátů lidé vylučují velké množstvíchloridu sodného pocením.
chlorid sodný je nepostradatelnýlidé. Celkové množství sodných iontů obsažených u dospělých je asi 60 g,z nichž 80% je v extracelulární tekutině,tj. Chlorid je také přítomen hlavně v extracelulární tekutině. Thefyziologické funkce sodných a chloridových iontů jsou:
(1) udržování osmotického tlaku extracelulární tekutiny.
(2) podílet se na regulaci acidobazické rovnováhy v těle.
(3) chlorid se podílí na produkcikyselina žaludeční v těle. Kromě toho hraje roli také chlorid sodnýudržování normální excitability nervů a svalů.
zemědělství
jeho vodný roztok může být použit pro sběr semen. Roztok NaCl je konfigurován podle potřebdruhů a jeho hustota je větší než hustota vody. Semena jsou vloženanaklový roztok, plovoucí plný a potopení plné.
ostatní
Podle nových zjištění zveřejněných SingaporeScience a Technology Research Institute, chlorid sodný může significantlyincrease kapacity pevných disků. Konkrétně existujícíkonvenční pevný disk používá náhodně přidělené magnetické diskové úložištětechnologie, která může dosáhnout pouze hustoty dat 0,5 TB na čtvereční palec.
nová technologie těží z pomoci chloridu sodného. S novou technologií litografického faktoru s vysokým rozlišením bude datadisk uspořádanější a dosáhne 3.3TB na čtvereční palec bez nutnosti složitých upgradů zařízení. Použití pevného disku 1TB s tímtotechnologie může dosáhnout kapacity 6TB bez přidání disků.
- Amoniaku Vzorce || proč amoniak je toxický || Amoniaku Otravě
- Proč Ozonovou Vrstvu, je Důležité || poškozování Ozonové Vrstvy
- Jaká je Koncentrace roztoku || Jak Koncentrace Ovlivňuje Reakce
- Proč Cyklu Uhlíku je Důležité, | | Jak to Funguje
- Haloalkanes a Haloarenes NCERT Řešení || Haloalkane Struktura
- Oxid Uhličitý Cyklus a Vzorce || Jak Oxid Uhličitý je Produkován
Leave a Reply