Natriumchloridegenskaber / / er natriumchlorid godt for dig?
Artikelemner
natriumchlorid er en ionisk forbindelse med den kemiske formel NaCl. Det er en farveløs kubisk krystal eller fint krystallinsk pulver og smager salt.
udseendet er en hvid krystal, og dens kilde er hovedsageligt havvand, som er hovedkomponenten i bordsalt. Opløselig i vand, glycerin, let opløselig i ethanol (alkohol), flydende ammoniak, uopløselig i koncentreret saltsyre. Urent natriumchlorid er delikat i luften.
stabiliteten er relativt god, og dens vandige opløsning er neutral. I mange tilfælde er det nødvendigt at anvende en elektrolytisk mættet natriumchloridopløsning til fremstilling af hydrogen, chlor og kaustisk soda (natriumhydroksid) og andre kemiske produkter (almindeligvis kaldet Chlor-alkali industri).
det kan bruges til malmsmeltning (elektrolytisk smeltning af natriumchloridkrystaller til fremstilling af aktivmetalnatrium), medicinsk brugt til at konfigurere fysiologisk saltvand og dagliglivetkan bruges til krydderier.
introduktion af forbindelse
grundlæggende oplysninger
engelsk navn: natriumchlorid
engelsk alias: natriumhydrochlorid; Sodiumchlorid
CAS-nummer: 7647-14-5
molekylformel: NaCl
molekylvægt: 58.44280
nøjagtig masse: 57.95860
sikkerhedsoplysninger
toldkode: 2501002000
farekategori kode: R36; R22
sikkerhedsinstruktioner: S24/25-S26
farligt gods tegn: hi
fysiske egenskaber af natriumchlorid
udseende og egenskaber: farveløs krystal ellerhvidt pulver
densitet: 2.165g/cm3 (25 liter C)
vandopløselighed: 360 g/L (25 liter)
stabilitet: Stabil under normale forsendelses-og håndteringsforhold.
opbevaringsbetingelser: lav temperatur, ventileret ogtør på lager
damptryk: 1 mm Hg (865 liter C)
smeltepunkt: 801 liter C
kogepunkt: 1465 liter
natriumchlorid er et hvidt lugtfrit krystallinsk pulver. Mp 801 deg.] C, et kogepunkt på 1465 grader.] C, let opløselig i ethanol, propanol, butan, butan, og efter at plasmaet bliver blandbart, opløseligt i vand, vandopløseligheden på 35,9 g (stuetemperatur).
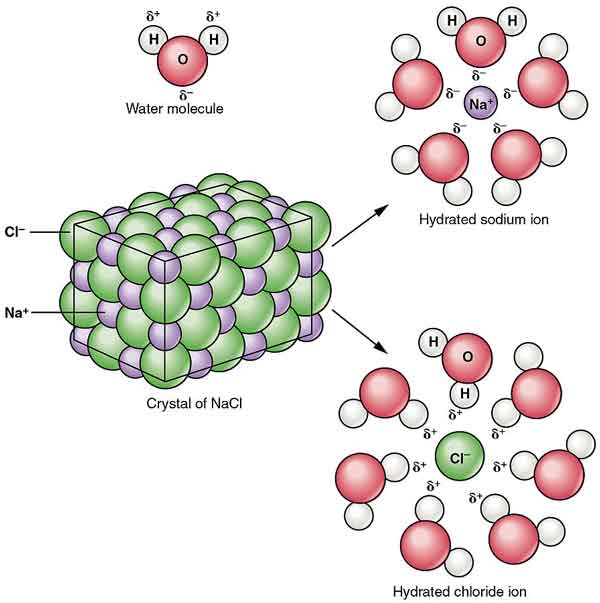
NaCl spredes i alkohol til dannelse af kolloider. Dens opløselighed i vand reduceres ved tilstedeværelsen af hydrogenchlorid, og det er næsten uopløseligt i koncentreret saltsyre.
kemiske egenskaber af natriumchlorid
krystallerne af natriumchlorid danner stereo symmetri. I sin krystalstruktur danner de større chloridioner den tætteste pakning i terningen, og de mindre natriumioner fylder det oktaedriske mellemrum mellem chloridionerne. Each ion is surrounded by six other ions. This structure is also found in many other compounds, called sodium chloride type structure or stone salt structure.

1. Preparationof sodium metal by electrolytic melting of sodium chloride
2NaCl(molten) = 2Na + Cl2
2. Electrolytic saltwater
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
3. React withsilver nitrate
NaCl + AgNO3 = NaNO3 + AgCl
Ionic equation:
Cl– + Ag+ = AgCl
(Which is theessence CI – property)
4. Reaction withconcentrated sulfuric acid (laboratory hydrogen chloride)
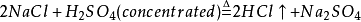

( Concentrated behalfconcentrated, Excess Representative excess)
5.NaCl test
A: chlorid blev tilsat dråbevis til en opløsning af salpetersyre havde forsuret opløsning af sølvnitrat, et hvidt bundfald (udfældet sølvchlorid) genereres, bevist CI– .
B: Dyp en lille mængde opløsning med platinetråd og læg den på en alkohollampe for at brænde. Flammen er gul, og det kan bevises, at den indeholder Na+.
C: for at eliminere interferens kan den originale testopløsning tilsættes med mættet bariumhydroksid, indtil det er åbenlyst alkalisk. På dette tidspunkt vil de fleste kationer og anioner som PO43− og AsO43− blive udfældet.
Ba2+ indført i testopløsningen skal fjernes med ammoniumcarbonat, og til sidst skal ammoniumsalt fjernes ved forbrænding. Efter at resten var udvasket med vand, blev opløsningen syrnet med HAc, og uranyl-sincacetatreagensen blev tilsat i henhold til antallet af dråber på 1: 8, og rørvæggen blev gnides med en glasstang. Hvis der blev dannet citrongule krystaller, var Na+ til stede.
fremstilling af natriumchlorid
industriel metode
indført i saltfelter med havvand (gennemsnit på 2.4% natriumchlorid) og tørret i solen, koncentreret til krystallisering for at opnå et råprodukt. Havvandet kan også opvarmes med damp, filtreres af et sandfilter og koncentreres ved ionbytningsmembranelektrodialyse for at opnå saltvand (indeholdende natriumchlorid 160-180 g / L). halogipsen udfældes ved fordampning, og den opnåede chloriner centrifugeres. Mere end 95% natrium (2% fugt) kan tørres for at opnåfælles salt. Rock salt og salt lake saltvand kan også bruges som råmaterialer og tørres i solen for at opnå rå salt.
når underjordisk saltvand og brøndsalt anvendes som råmaterialer, er dekoncentreret ved tre – eller fire-effekt fordampning, krystaller udfældes og centrifugeres for at opnå.
laboratoriemetode
råsaltet opløses i vand for at fjerne uopløselige urenheder, og raffinerede præparater, såsom natriumhydroksid og natriumcarbonat tilsættes for at gøre opløselige urenheder, såsom SO42 -, Ca2+ og Mg2+, udfældes, filtreres for at fjerne og til sidst oprenset med pH blev justeret til 7 med saltsyre, og opløsningen blev koncentreret for at opnå rene natriumchloridkrystaller.
præparatetmetode i laboratoriet er at blande en lige stor mængde saltsyre mednatriumhydroksid til dannelse af en natriumchloridopløsning. Opløsningen blev dendestilleret for at opnå natriumchloridkrystaller. Hovedreaktionen:
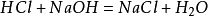
derudover vil natriumchlorid også producere natriumchlorid,når det antændes imiljø af klorgas. Dens kemiske ligning er:
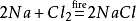
hvad anvendes natriumchlorid til
industri
1. Når elektrolytisk natriumchloridopløsning erelektrolyseret, vil hydrogen og chlorgas blive genereret. Klorgas har en lang række anvendelser i den kemiske industri og kan bruges tilsyntetisere polyvinylchlorid, pesticider, saltsyre osv.
2. Fremstilling af natriummetal ved Dangsmetoden: fremstilling af natriummetal ved elektrolytisk smeltning af en blanding af natriumchlorid og calciumchlorid. Calciumchlorid anvendes som en strøm til at sænkesmeltepunktet for natriumchlorid under 700 liter C. Calcium er mindrereducerende end natrium og indfører ikke urenheder.
3. Natriumchlorid er nødvendigt for mange biologiskereaktioner. For eksempel forskellige opløsningsformler i molekylærbiologieksperimenter indeholder natriumchlorid, og det meste af bakteriekulturmedietindeholder natriumchlorid. Det er også råmaterialet i produktionen afsodavand ved ammoniak-alkali-metoden.
4. Uorganiske og organiske industrier anvendes som råmaterialer til fremstilling af kaustisk soda, chlorat, hypochlorit, blegepulver, kølemidler til kølesystemer, råmaterialer til organisk syntese og saltningsmidler. Stålindustrien anvendes som varmebehandlingsmiddel. En varmekilde ved høj temperatur bruges til at danne et saltbad med kaliumchlorid, bariumchlorid osv., som kan bruges som et opvarmningsmedium til at opretholde temperaturen mellem 820-960 liter C. Derudover bruges den også i glas, farvestoffer, metallurgi og andre industrier.
5. Analysereagenser anvendes som fluor-og silicatrace-analysereagenser.
6. Sodaaskeproduktion ved Hou ‘ s alkalimetode: det andet trin: ammoniumbicarbonatopløsningen fremstillet i det første trin blandes med natriumchloridopløsningen for at opnå natriumbicarbonat ogammoniumchlorid ved 10 liter C.
fødevareindustrien
fødevareindustrien og fiskeriet anvendes tilsaltning samt råvarer til krydderier og raffineret bordsalt.
tilsætning af salt til madlavning retter kan fjerne nogle lugteaf råvarer og øge smagen, hvilket er effekten af saltfriskhed. “Lidt smagløst, salt og smagløst” betyder detDen rigtige mængde salt kan bruges til at udøve sine unikke funktioner.
medicinsk
natriumchlorid er meget vigtigt for livet påjorden. De fleste biologiske væv indeholder flere salte. Denkoncentration af natrium i blodet er direkte relateret til reguleringen afdet sikre niveau af kropsvæsker. Ledningen af nerveimpulser forårsaget afsignalkonvertering reguleres også af natriumioner.
vand indeholdende 0,9% natriumchlorid kaldes saltvandfordi det har det samme osmotiske tryk som plasma. Normal saltvand erhovedkropsvæske erstatning. Det er meget udbredt i behandling og forebyggelseaf dehydrering, og det bruges også til behandling af intravenøs injektionog forebyggelse af hypovolemisk shock.
I modsætning til andre primater udskiller mennesker store mængderaf natriumchlorid gennem sved.
natriumchlorid er uundværlig formennesker. 60 g, hvoraf 80% er i ekstracellulær væske, det vil sige i plasma og intercellulærvæske. Chlorid er også hovedsageligt til stede i ekstracellulær væske. Detfysiologiske funktioner af natrium – og chloridioner er:
(1) opretholdelse af det ekstracellulære væskes osmotiske tryk.
(2) deltager i reguleringen af syre-base balance i kroppen.
(3) chlorid er involveret i produktionen afmavesyre i kroppen. Derudover spiller natriumchlorid også en rolle iopretholdelse af den normale spænding af nerver og muskler.
landbrug
dens vandige opløsning kan anvendes til frøudvælgelse. NaCl-opløsningen er konfigureret efter behovene iarter, og dens densitet er større end vandets. Frø sættes intoNaCl opløsning, flydende fuld og synker fuld.
andet
ifølge nye resultater udgivet af Singaporesci og Technology Research Institute kan natriumchlorid betydeligtøge kapaciteten på harddiske. Specifikt den eksisterendekonventionel harddisk bruger en tilfældigt tildelt magnetisk disklagringsteknologi, som kun kan opnå en datatæthed på 0,5 TB pr.
den nye teknologi drager fordel af hjælp fra natriumchlorid. Med den nye litografifaktorteknologi med høj opløsning, datadensiteten vil være mere ordnet, når 3.3 TB pr. kvadratcentimeter uden behovtil komplicerede udstyrsopgraderinger. Brug af 1 TB harddisk med detteteknologien kan nå 6 TB kapacitet uden at tilføje diske.
- Ammoniakformel | | hvorfor ammoniak er giftig | /ammoniakforgiftning
- hvorfor olielag er vigtigt | /Olielagudtømning
- hvad er koncentrationen af opløsning | /hvordan koncentration påvirker reaktionen
- hvorfor Kulstofcyklus er vigtigt | /hvordan det virker
- Haloalkaner og Haloarenes NCERT-opløsninger | /Haloalkanestruktur
- Kulstofcyklus og formel | /hvordan Kulstofcyklus er produceret
Leave a Reply