Natriumklorid Egenskaper / / er natriumklorid bra for deg?
Artikkel Emner
Natriumklorid Er En ionisk forbindelse med kjemisk formel NaCl. Det er en fargeløs kubisk krystall eller fint krystallinsk pulver og smaker salt.
utseendet er en hvit krystall, og kilden er hovedsakelig sjøvann, som er hovedkomponenten i bordsalt. Oppløselig i vann, glyserin, litt løselig i etanol (alkohol), flytende ammoniakk, uoppløselig i konsentrert saltsyre. Urent natriumklorid er deliquescent i luft.
stabiliteten er relativt god, og dens vandige løsning er nøytral. Industrielt brukes metoden for elektrolytisk mettet natriumkloridoppløsning vanligvis til å produsere hydrogen, klor og kaustisk soda (natriumhydroksyd) og andre kjemiske produkter (ofte kalt Kloralkaliindustri).
Det kan brukes i malmsmelting (elektrolytisk smelting av natriumkloridkrystaller for å produsere aktivmetallnatrium), medisinsk brukt til å konfigurere fysiologisk saltvann og daglig levetidkan brukes til krydder.
Sammensatte Innledning
Grunnleggende Informasjon
engelsk navn: natriumklorid
engelsk alias: natriumhydroklorid; Sodiumchloride
CAS nummer: 7647-14-5
Molekylformel: NaCl
Molekylvekt: 58.44280
Eksakt masse: 57.95860
sikkerhetsinformasjon
tollkode: 2501002000
fare kategori kode: r36; r22
Sikkerhetsinstruksjoner: S24/25-s26
tegn på farlig gods: xi
fysiske Egenskaper av natriumklorid
utseende og egenskaper: fargeløs krystall ellerhvitt pulver
tetthet: 2.165g / cm3 (25 ° C)
vannløselighet: 360 g / L (25 º)
Stabilitet: Stabil under normale frakt-og håndteringsforhold.
lagringsforhold: lav temperatur, ventilert ogtørr på lager
Damptrykk: 1 mm Hg (865 ° C)
Smeltepunkt: 801 ° C
Kokepunkt: 1465 ℃
Natriumklorid er et hvitt luktfritt krystallinsk pulver. Mp 801 deg.] C, et kokepunkt på 1465 deg . ] C, litt løselig i etanol, propanol, butan, butan, og etter at plasmaet blir blandbart, oppløselig i vann, vannløseligheten på 35,9 g (romtemperatur).
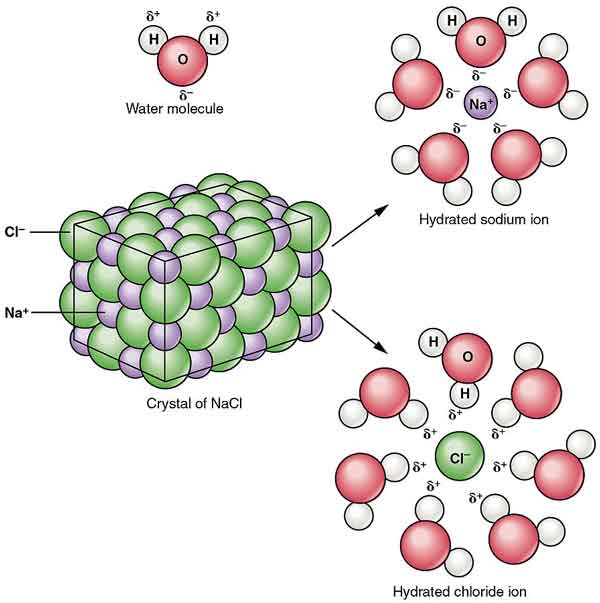
NaCl dispergeres i alkohol for å danne kolloider. Dens oppløselighet i vann reduseres ved nærvær av hydrogenklorid, og det er nesten uoppløselig i konsentrert saltsyre.
Kjemiske egenskaper Av Natriumklorid
krystallene av natriumklorid danner stereosymmetri. I sin krystallstruktur danner de større kloridioner den tetteste pakningen i terningen, og de mindre natriumioner fyller oktaedisk gap mellom kloridioner. Each ion is surrounded by six other ions. This structure is also found in many other compounds, called sodium chloride type structure or stone salt structure.

1. Preparationof sodium metal by electrolytic melting of sodium chloride
2NaCl(molten) = 2Na + Cl2
2. Electrolytic saltwater
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
3. React withsilver nitrate
NaCl + AgNO3 = NaNO3 + AgCl
Ionic equation:
Cl– + Ag+ = AgCl
(Which is theessence CI – property)
4. Reaction withconcentrated sulfuric acid (laboratory hydrogen chloride)
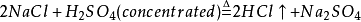

( Concentrated behalfconcentrated, Excess Representative excess)
5.NaCl test
A: klorid ble tilsatt dråpevis til en løsning av salpetersyre hadde surgjort løsning av sølvnitrat, en hvit bunnfall (utfelt sølvklorid) er generert, viste CI– .
B: Dip en liten mengde løsning med platintråd og sett den på en alkohollampe for å brenne. Flammen er gul og Det kan påvises At Den inneholder Na+.
C: for å eliminere interferens kan den opprinnelige testløsningen tilsettes med mettet bariumhydroksyd til den er åpenbart alkalisk. På denne tiden vil de fleste kationer og anioner SOM PO43− Og AsO43− bli utfelt.
Ba2 + introdusert i testoppløsningen bør fjernes med ammoniumkarbonat, og til slutt bør ammoniumsalt fjernes ved brenning. Etter at resten ble lekket med vann, ble oppløsningen surgjort Med HAc, og uranylsinkacetatreagenset ble tilsatt i henhold til antall dråper på 1: 8, og rørveggen ble gnidd med en glassstang. Hvis sitron-gule krystaller ble dannet, Var Na + tilstede.
Fremstilling Av Natriumklorid
Industriell metode
Introdusert i saltfelt med sjøvann (gjennomsnitt på 2.4% natriumklorid) og tørket i solen, Konsentrert for å krystallisere for å oppnå et råprodukt. Sjøvannet kan også varmes opp med damp, filtreres av et sandfilter og konsentreres av ionbyttermembranelektrodialyse for å oppnå saltlake (som inneholder natriumklorid 160-180g / L).
halogipset utfelles ved fordampning, og det oppnådde klorerer sentrifugert. Mer enn 95% natrium (2% fuktighet) kan tørkes for å oppnåvanlig salt. Rock salt og salt lake saltlake kan også brukes som råmaterialer og tørket i solen for å oppnå rå salt.
når underjordisk saltlake og brønnsalt brukes som råvarer, er dekonsentrert av tre-eller fire-effekt fordampning, krystaller utfelles og sentrifugeres for å oppnå.
Laboratoriemetode
det rå saltet oppløses i vann for å fjerne uoppløselige urenheter, og raffinerte preparater som natriumhydroksyd og natriumkarbonat tilsettes for å gjøre oppløselige urenheter SOM SO42 -, Ca2 + Og Mg2 + blir utfelles, filtrert for å fjerne og til slutt renset med pH ble justert til 7 med saltsyre, og løsningen ble konsentrert for å oppnå rene natriumkloridkrystaller.
preparatetmetode i laboratoriet er å blande like mye saltsyre mednatriumhydroksyd for å danne en natriumkloridløsning. Løsningen ble dadestillert for å oppnå natriumkloridkrystaller. Hovedreaksjonen:
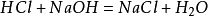
i tillegg vil natriumklorid også produsere natriumklorid når det antennes imiljø av klorgass. Dens kjemiske ligning er:
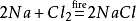
Hva Er Natriumklorid brukt til
Industri
1. Når elektrolytisk natriumkloridoppløsning erelektrolysert, hydrogen og klorgass vil bli generert. Klorgass har enbredt spekter av applikasjoner i kjemisk industri og kan brukes tilsyntetisere polyvinylklorid,plantevernmidler, saltsyre, etc.
2. Fremstilling av natriummetall Ved Dangs-metoden: Fremstilling av natriummetall ved elektrolytisk smelting av en blanding av natriumklorid og kalsiumklorid. Kalsiumklorid brukes som en fluss for å senkesmeltepunktet av natriumklorid under 700 ° C. Kalsium er mindre reduserende enn natrium og innfører ikke urenheter.
3. Natriumklorid er nødvendig for mange biologiskereaksjoner. For eksempel, forskjellige løsningsformler i molekylærbiologieksperimenter inneholder natriumklorid, og det meste av bakteriekulturmedietinneholder natriumklorid. Det er også råmaterialet i produksjonen avsoda aske ved ammoniakk-alkali-metoden.
4. Uorganiske og organiske næringer brukes som råmaterialer for produksjon av kaustisk soda, klorat, hypokloritt, blekepulver, kjølemidler for kjølesystemer, råvarer for organisk syntese og saltutløsende midler. Stålindustrien brukes som et varmebehandlingsmiddel. En høy temperatur varmekilde brukes til å danne et saltbad med kaliumklorid, bariumklorid, etc., som kan brukes som oppvarmingsmedium for å opprettholde temperaturen mellom 820-960 ° C. i tillegg brukes den også i glass, fargestoffer, metallurgi og andre næringer.
5. Analytiske reagenser brukes som fluor-og silikatsporanalysereagenser.
6. Soda produksjon Ved hous alkalimetode: det andre trinnet: ammoniumbikarbonatløsningen fremstilt i første trinn er blandet med natriumkloridoppløsningen for å oppnå natriumbikarbonat ogammoniumklorid ved 10°C.
Næringsmiddelindustrien
næringsmiddelindustrien og fiskeriene brukes tilsalt, samt råvarer til krydder og raffinert bordsalt.
Tilsetning av salt til matlaging kan fjerne litt luktav råvarer og øke smaken, som er effekten av saltfriskhet. «Litt smakløst, salt og smakløst» betyr detden riktige mengden salt kan brukes til å utøve sine unike funksjoner.
Medisinsk
Natriumklorid er svært viktig for livet påjorden. De fleste biologiske vev inneholder flere salter. Konsentrasjonen av natrium i blodet er direkte relatert til reguleringen avdet sikre nivået av kroppsvæsker. Ledningen av nerveimpulser forårsaket avsignalomdannelse reguleres også av natriumioner.
Vann som inneholder 0,9% natriumklorid kalles saltholdig fordi det har samme osmotiske trykk som plasma. Normal saltvann erhovedkroppsfluid erstatning. Det er mye brukt i behandling og forebyggingav dehydrering, og det brukes også til behandling av intravenøs injeksjonog forebygging av hypovolemisk sjokk.
I Motsetning til andre primater, utskiller mennesker store mengderav natriumklorid gjennom svette.
Natriumklorid er uunnværlig formennesker. 60g, hvorav 80% er i ekstracellulær væske, det vil si i plasma og intercellulærvæske. Klorid er også hovedsakelig tilstede i ekstracellulær væske. Denfysiologiske funksjoner av natrium – og kloridioner er:
(1) opprettholde det osmotiske trykket av det ekstracellulære væsken.
(2) delta i reguleringen av syrebasebalanse i kroppen.
(3) Klorid er involvert i produksjonen avmagesyre i kroppen. I tillegg spiller natriumklorid også en rolle iopprettholde normal spenning av nerver og muskler.
Landbruk
dens vandige løsning kan brukes til frøutvalg. Nacl-løsningen er konfigurert i henhold til behovene tilarter, og dens tetthet er større enn vannets. Frø er satt intoNaCl løsning, flytende full og synker full.
andre
ifølge nye funn utgitt Av SingaporeScience and Technology Research Institute, kan natriumklorid betydeligøke kapasiteten til harddisker. Spesielt bruker existingconventional harddisken en tilfeldig tildelt magnetisk disklagreteknologi, som bare kan oppnå en datatetthet på 0,5 TB per kvadratmeter.
den nye teknologien drar nytte av sodiumklorid. Med den nye høyoppløselige litografi faktor teknologi, datadensity vil være mer ryddig, nå 3.3TB per kvadrattomme uten behovfor kompliserte utstyrsoppgraderinger. Bruke 1tb harddisk med detteteknologien kan nå 6tb kapasitet uten å legge til plater.
- Ammoniakk Formel | | hvorfor ammoniakk er giftig | /Ammoniakk Forgiftning
- Hvorfor Ozonlaget Er Viktig | /Ozonlaget Uttømming
- Hva Er Konsentrasjonen av løsningen | /Hvordan Konsentrasjonen Påvirker Reaksjon
- Hvorfor Karbon Syklus Er Viktig | /Hvordan Det Fungerer
- Haloalkaner OG Haloarenes NCERT Løsninger | /Haloalkane Struktur
- Karbondioksid Syklus og Formel | /Hvordan Karbondioksid Produseres
Leave a Reply