Propriétés du chlorure de sodium // Le chlorure de sodium est-il bon pour vous?
Sujets de l’article
Le chlorure de sodium est un composé ionique de formule chimique NaCl. C’est un cristal cubique incolore ou une poudre cristalline fine et a un goût salé.
L’apparence est un cristal blanc, et sa source est principalement l’eau de mer, qui est le composant principal du sel de table. Soluble dans l’eau, la glycérine, légèrement soluble dans l’éthanol (alcool), l’ammoniac liquide, insoluble dans l’acide chlorhydrique concentré. Le chlorure de sodium impur est déliquescent dans l’air.
La stabilité est relativement bonne et sa solution aqueuse est neutre. Industriellement, la méthode de solution de chlorure de sodium saturée électrolytiquement est généralement utilisée pour produire de l’hydrogène, du chlore et de la soude caustique (hydroxyde de sodium) et d’autres produits chimiques (communément appelés industrie du chlore-alcali).
Il peut être utilisé dans la fusion des minerais (fusion électrolytique de cristaux de chlorure de sodium pour produire du sodium actif), utilisé médicalement pour configurer une solution saline physiologique, et la vie quotidienne peut être utilisée pour les condiments.
Introduction du composé
Informations de base
Nom anglais: chlorure de sodium
Alias anglais: chlorhydrate de sodium; chlorure de sodium
Numéro CAS: 7647-14-5
Formule moléculaire: NaCl
Poids moléculaire: 58,44280
Masse exacte: 57,95860
Informations de sécurité
Code douanier: 2501002000
Code de catégorie de danger: R36; R22
Consignes de sécurité: S24 / 25-S26
Signe de marchandises dangereuses: Xi
Propriétés physiques du chlorure de sodium
Apparence et propriétés: cristal incolore oupoudre blanche
Densité: 2.165 g /cm3 (25 ° C)
Solubilité dans l’eau: 360 g /L (25 ºC)
Stabilité: Stable dans des conditions normales d’expédition et de manutention.
Conditions de stockage: basse température, ventilé et sec dans l’entrepôt
Pression de vapeur: 1 mm Hg (865 ° C)
Point de fusion: 801 ° C
Point d’ébullition: 1465 ℃
Le chlorure de sodium est une poudre cristalline blanche inodore. Mp 801 degrés.] C, un point d’ébullition de 1465 deg.] C, légèrement soluble dans l’éthanol, le propanol, le butane, le butane, et après que le plasma devienne miscible, soluble dans l’eau, la solubilité dans l’eau de 35,9 g (température ambiante).
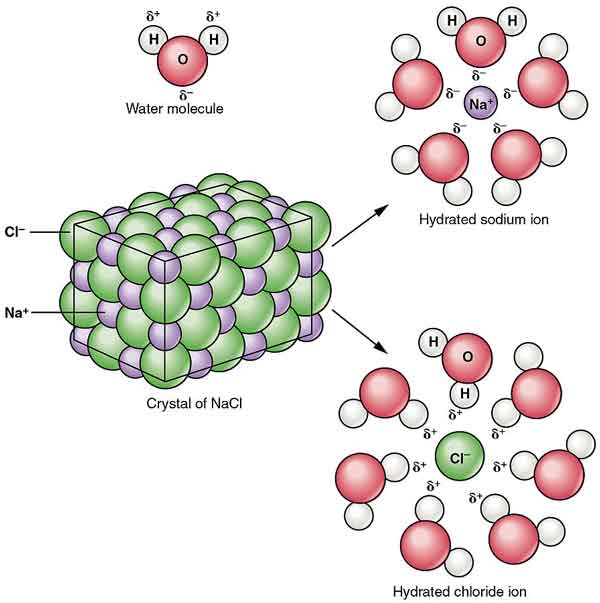
Le NaCl est dispersé dans l’alcool pour former des colloïdes. Sa solubilité dans l’eau est réduite par la présence de chlorure d’hydrogène et il est presque insoluble dans l’acide chlorhydrique concentré.
Propriétés chimiques du chlorure de sodium
Les cristaux de chlorure de sodium forment une symétrie stéréo. Dans sa structure cristalline, les ions chlorure plus gros forment l’emballage le plus dense du cube, et les ions sodium plus petits remplissent l’espace octaédrique entre les ions chlorure. Each ion is surrounded by six other ions. This structure is also found in many other compounds, called sodium chloride type structure or stone salt structure.

1. Preparationof sodium metal by electrolytic melting of sodium chloride
2NaCl(molten) = 2Na + Cl2
2. Electrolytic saltwater
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
3. React withsilver nitrate
NaCl + AgNO3 = NaNO3 + AgCl
Ionic equation:
Cl– + Ag+ = AgCl
(Which is theessence CI – property)
4. Reaction withconcentrated sulfuric acid (laboratory hydrogen chloride)
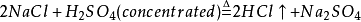

( Concentrated behalfconcentrated, Excess Representative excess)
5.NaCl test
A: du chlorure a été ajouté goutte à goutte à une solution d’acide nitrique ayant une solution acidifiée de nitrate d’argent, un précipité blanc (chlorure d’argent précipité) est généré, prouvé CI–.
B: Trempez une petite quantité de solution avec du fil de platine et mettez-la sur une lampe à alcool pour la brûler. La flamme est jaune et il peut être prouvé qu’elle contient du Na+.
C: Afin d’éliminer les interférences, la solution d’essai originale peut être ajoutée avec de l’hydroxyde de baryum saturé jusqu’à ce qu’elle soit manifestement alcaline. À ce moment, la plupart des cations et anions tels que PO43 − et AsO43 − seront précipités.
Le Ba2+ introduit dans la solution d’essai doit être éliminé par du carbonate d’ammonium, et enfin le sel d’ammonium doit être éliminé par combustion. Après lixiviation du résidu avec de l’eau, la solution a été acidifiée avec du HAc, et le réactif acétate d’uranyle-zinc a été ajouté selon le nombre de gouttes de 1: 8, et la paroi du tube a été frottée avec une tige de verre. Si des cristaux jaune citron se sont formés, du Na + était présent.
Préparation du chlorure de sodium
Méthode industrielle
Introduit dans les champs de sel par l’eau de mer (moyenne de 2.chlorure de sodium à 4%) et séché au soleil, Concentré pour cristalliser pour obtenir un produit brut. L’eau de mer peut également être chauffée à la vapeur, filtrée par un filtre à sable et concentrée par électrodialyse à membrane échangeuse d’ions pour obtenir de la saumure (contenant du chlorure de sodium 160-180g/L).
Le gypse halo est précipité par évaporation et la chlorine obtenue est centrifugée. Plus de 95% de sodium (2% d’humidité) peuvent être séchés pour obtenirsal commun. Le sel gemme et la saumure de lac salé peuvent également être utilisés comme matériaux bruts et séchés au soleil pour obtenir du sel brut.
Lorsque la saumure souterraine et le sel de puits sont utilisés comme matières premières, ils sont concentrés par évaporation à trois ou quatre effets, les cristaux sont précipités et centrifugés pour obtenir.
Méthode de laboratoire
Le sel brut est dissous dans l’eau pour éliminer les impuretés insolubles, et des préparations raffinées telles que l’hydroxyde de sodium et le carbonate de sodium sont ajoutées pour faire des impuretés solubles telles que SO42-, Ca2+ et Mg2+ deviennent des précipités, filtrées pour les éliminer, et enfin purifiées avec le pH ajusté à 7 avec de l’acide chlorhydrique, et la solution a été concentrée pour obtenir des cristaux de chlorure de sodium purs.
La méthode de préparation en laboratoire consiste à mélanger une quantité égale d’acide chlorhydrique avec de l’hydroxyde de sodium pour former une solution de chlorure de sodium. La solution a ensuite été distillée pour obtenir des cristaux de chlorure de sodium. La réaction principale:
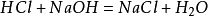
En outre, le chlorure de sodium produira également du chlorure de sodium lorsqu’il sera enflammé dans l’environnement de chlore gazeux. Son équation chimique est:
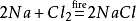
qu’est-ce que le chlorure de sodium utilisé pour l’industrie
1. Lorsque la solution de chlorure de sodium électrolytique estélectrolysé, de l’hydrogène et du chlore gazeux seront générés. Le chlore gazeux a une large gamme d’applications dans l’industrie chimique et peut être utilisé pour synthétiser le chlorure de polyvinyle, les pesticides, l’acide chlorhydrique, etc.
2. Préparation du métal sodique par la méthode Dangs: Préparation du métal sodique par fusion électrolytique d’un mélange de chlorure de sodium et de chlorure de calcium. Le chlorure de calcium est utilisé comme flux pour abaisser le point de fusion du chlorure de sodium en dessous de 700 ° C. Le calcium est moins réducteur que le sodium et n’introduit pas d’impuretés.
3. Le chlorure de sodium est nécessaire pour de nombreux produits biologiquesréactions. Par exemple, diverses formules de solution en biologie moléculaire contiennent des expériences contenant du chlorure de sodium, et la majeure partie du milieu de culture bactérien contient du chlorure de sodium. C’est également la matière première dans la production de cendres de soda par la méthode ammoniac-alcali.
4. Les industries inorganiques et organiques sont utilisées comme matières premières pour la production de soude caustique, de chlorate, d’hypochlorite, de poudre de blanchiment, de réfrigérants pour systèmes de réfrigération, de matières premières pour la synthèse organique et d’agents de salage. L’industrie sidérurgique est utilisée comme agent de traitement thermique. Une source de chaleur à haute température est utilisée pour former un bain de sel avec du chlorure de potassium, du chlorure de baryum, etc., qui peut être utilisé comme moyen de chauffage pour maintenir la température entre 820 et 960 ° C. En outre, il est également utilisé dans le verre, les colorants, la métallurgie et d’autres industries.
5. Les réactifs analytiques sont utilisés comme réactifs d’analyse du fluor et du silicatetrace.
6. Production de carbonate de sodium par la méthode alcaline de Hou: la deuxième étape: la solution de bicarbonate d’ammonium préparée dans la première étape est mélangée à la solution de chlorure de sodium pour obtenir du bicarbonate de sodium et du chlorure d’ammonium à 10 ° C.
Industrie alimentaire
L’industrie alimentaire et la pêche sont utilisées pour le sel, ainsi que les matières premières pour les assaisonnements et le sel de table raffiné.
Ajouter du sel à la cuisson des plats peut éliminer certaines odeurs de matières premières et augmenter le goût, ce qui est l’effet de la fraîcheur du sel. « Légèrement insipide, salé et insipide » signifie quela quantité appropriée de sel peut être utilisée pour exercer ses fonctions uniques.
Médical
Le chlorure de sodium est très important pour la viela terre. La plupart des tissus biologiques contiennent de multiples sels. La concentration du sodium dans le sang est directement liée à la régulation du niveau de sécurité des fluides corporels. La conduction de l’influx nerveux causée parla conversion du signal est également régulée par les ions sodium.
L’eau contenant 0,9% de chlorure de sodium est appelée saline, car elle a la même pression osmotique que le plasma. Une solution saline normale est leprincipal substitut de liquide corporel. Il est largement utilisé dans le traitement et la prévention de la déshydratation, et il est également utilisé dans le traitement de l’injection intraveineuse et la prévention du choc hypovolémique.
Contrairement aux autres primates, les humains sécrètent de grandes quantités de chlorure de sodium par transpiration.
Le chlorure de sodium est indispensable pourles humains. La quantité totale d’ions sodium contenue chez les adultes est d’environ 60 g, dont 80% dans le liquide extracellulaire, c’est-à-dire dans le plasma et le fluide intercellulaire. Le chlorure est également principalement présent dans le liquide extracellulaire. Les fonctions physiologiques des ions sodium et chlorure sont les suivantes:
(1) maintien de la pression osmotique du liquide extracellulaire.
(2) participer à la régulation de l’équilibre acido-basique dans le corps.
(3) Le chlorure est impliqué dans la production deacide gastrique dans le corps. En outre, le chlorure de sodium joue également un rôle dansmaintenir l’excitabilité normale des nerfs et des muscles.
Agriculture
Sa solution aqueuse peut être utilisée pour la sélection des semences. La solution de NaCl est configurée en fonction des besoins deespèces, et sa densité est supérieure à celle de l’eau. Les graines sont mises en solution d’ammoNiAc, flottant à fond et coulant à fond.
autres
Selon de nouvelles conclusions publiées par l’Institut de recherche sur les sciences et la technologie de Singapour, le chlorure de sodium peut considérablement augmenter la capacité des disques durs. Plus précisément, le disque dur conventionnel existant utilise une technologie de stockage de disque magnétique allouée aléatoirement, qui ne peut atteindre qu’une densité de données de 0,5 To par pouce carré.
La nouvelle technologie bénéficie de l’aide du chlorure de sodium. Avec la nouvelle technologie de facteur de lithographie à haute résolution, la densité de données sera plus ordonnée, atteignant 3.3 To par pouce carré sans les mises à niveau d’équipement compliquées nécessaires. Utilisation d’un disque dur de 1 To avec cette technologie peut atteindre une capacité de 6 To sans ajouter de disques.
- Formule de l’ammoniac ||pourquoi l’ammoniac est toxique |/Empoisonnement à l’ammoniac
- Pourquoi La Couche d’Ozone est Importante |/Appauvrissement de la Couche d’Ozone
- Quelle est la Concentration de la solution |/Comment La Concentration Affecte la Réaction
- Pourquoi Le Cycle du Carbone est Important |/Comment cela Fonctionne
- Haloalcanes et Haloarènes Solutions NCERT |/Structure des Haloalcanes
- Cycle et Formule du Dioxyde de Carbone |/Comment le Dioxyde de carbone est produit
- >
Leave a Reply