Natriumkloridegenskaper / / är natriumklorid bra för dig?
artikelämnen
natriumklorid är en jonisk förening med den kemiska formeln NaCl. Det är en färglös kubisk kristall eller fint kristallint pulver och smakar salt.
utseendet är en vit kristall, och dess källa är främst havsvatten, vilket är huvudkomponenten i bordsalt. Löslig i vatten, glycerin, något löslig i etanol (alkohol), flytande ammoniak, olöslig i koncentrerad saltsyra. Oren natriumklorid är deliquescent i luft.
stabiliteten är relativt god och dess vattenlösning är neutral. Industriellt används metoden för elektrolytiskt mättad natriumkloridlösning vanligtvis för att producera väte, klor och kaustik soda (natriumhydroxid) och andra kemiska produkter (vanligtvis kallad Kloralkaliindustri).
det kan användas i malmersmältning (elektrolytisk smältning av natriumkloridkristaller för att producera aktivmetallnatrium), medicinskt används för att konfigurera fysiologisk saltlösning och det dagliga livetkan användas för kryddor.
förening introduktion
grundläggande Information
engelska namn: natriumklorid
engelska alias: natriumhydroklorid; natriumklorid
CAS-nummer: 7647-14-5
Molekylformel: NaCl
Molekylvikt: 58.44280
exakt massa: 57.95860
säkerhetsinformation
tullkodex: 2501002000
riskkategorikod: R36; R22
Säkerhetsanvisningar: S24/25-S26
farligt godsskylt: Xi
fysikaliska egenskaper hos natriumklorid
utseende och egenskaper: färglös kristall ellervitt pulver
densitet: 2.165g/cm3 (25 ci c)
vattenlöslighet: 360 g/L (25 CI CC)
stabilitet: Stabil under normala frakt-och hanteringsförhållanden.
lagringsförhållanden: låg temperatur, ventilerad ochtorr i lager
ångtryck: 1 mm Hg (865 ci C)
Smältpunkt: 801 c c
kokpunkt: 1465 C.
natriumklorid är ett vitt luktfritt kristallint pulver. Mp 801 deg.] C, en kokpunkt på 1465 deg.] C, något löslig i etanol, propanol, butan, butan, och efter att plasman blir blandbar, löslig i vatten, vattenlösligheten på 35,9 g (rumstemperatur).
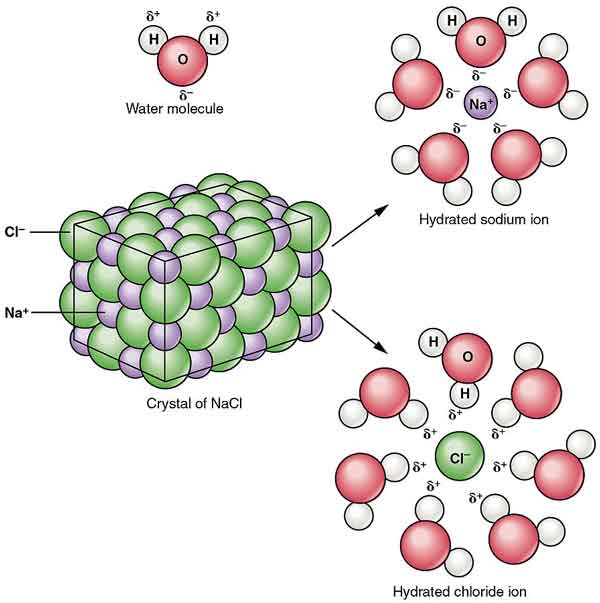
NaCl dispergeras i alkohol för att bilda kolloider. Dess löslighet i vatten reduceras genom närvaron av väteklorid, och det är nästan olösligt i koncentrerad saltsyra.
kemiska egenskaper hos natriumklorid
kristallerna av natriumklorid bildar stereosymmetri. I sin kristallstruktur bildar de större kloridjonerna den tätaste förpackningen i kuben, och de mindre natriumjonerna fyller det oktaedriska gapet mellan kloridjonerna. Each ion is surrounded by six other ions. This structure is also found in many other compounds, called sodium chloride type structure or stone salt structure.

1. Preparationof sodium metal by electrolytic melting of sodium chloride
2NaCl(molten) = 2Na + Cl2
2. Electrolytic saltwater
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
3. React withsilver nitrate
NaCl + AgNO3 = NaNO3 + AgCl
Ionic equation:
Cl– + Ag+ = AgCl
(Which is theessence CI – property)
4. Reaction withconcentrated sulfuric acid (laboratory hydrogen chloride)
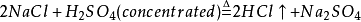

( Concentrated behalfconcentrated, Excess Representative excess)
5.NaCl test
A: klorid tillsattes droppvis till en lösning av salpetersyra hade surgjort lösning av silvernitrat, en vit fällning (utfälld silverklorid) alstras, bevisade CI– .
B: doppa en liten mängd lösning med platinatråd och lägg den på en alkohollampa för att brinna. Flammen är gul och det kan bevisas att den innehåller Na+.
C: för att eliminera störningar kan den ursprungliga testlösningen tillsättas med mättad bariumhydroxid tills den uppenbarligen är alkalisk. Vid denna tidpunkt kommer de flesta katjoner och anjoner som PO43− och AsO43− att fällas ut.
Ba2 + införd i testlösningen bör avlägsnas med ammoniumkarbonat och slutligen ammoniumsalt bör avlägsnas genom bränning. Efter att återstoden läcktes ut med vatten surgjordes lösningen med HAc och uranylzinkacetatreagensen tillsattes enligt antalet droppar av 1: 8 och rörväggen gnides med en glasstång. Om citrongula kristaller bildades var Na+ närvarande.
beredning av natriumklorid
industriell metod
införd i saltfält med havsvatten (genomsnitt 2.4% natriumklorid) och torkas i solen, koncentrerad för att kristallisera för att erhålla en råprodukt. Havsvattnet kan också värmas upp med ånga, filtreras av ett sandfilter och koncentreras genom jonbytarmembranelektrodialys för att erhålla saltlösning (innehållande natriumklorid 160-180g / L).
halogipsen fälls ut genom avdunstning och den erhållna klorencentrifugeras. Mer än 95% natrium (2% fukt) kan torkas för att erhållavanligt salt. Bergsalt och Salt lake saltlösning kan också användas som råmaterial och torkas i solen för att erhålla rå salt.
När underjordisk saltlösning och brunnsalt används som råmaterial, koncentreras de av tre – eller fyra-effektavdunstning, kristaller fälls ut och centrifugeras för att erhålla.
laboratoriemetod
det råa saltet löses i vatten för att avlägsna olösliga föroreningar, och raffinerade preparat såsom natriumhydroxid och natriumkarbonat tillsätts för att göra lösliga föroreningar såsom SO42-, Ca2+ och Mg2+ blir fällningar, filtreras för att avlägsna och slutligen renas med pH justerades till 7 med saltsyra, och lösningen koncentrerades för att erhålla rena natriumkloridkristaller.
preparatmetoden i laboratoriet är att blanda en lika stor mängd saltsyra mednatriumhydroxid för att bilda en natriumkloridlösning. Lösningen var dådestilleras för att erhålla natriumkloridkristaller. Huvudreaktionen:
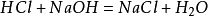
dessutom kommer natriumklorid också att producera natriumklorid när den antänds imiljö av klorgas. Dess kemiska ekvation är:
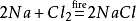
vad används natriumklorid för
industri
1. När elektrolytisk natriumkloridlösning ärelektrolyserad, väte och klorgas kommer att genereras. Klorgas har ett brett användningsområde inom kemisk industri och kan användas för attsyntetisera polyvinylklorid, bekämpningsmedel, saltsyra etc.
2. Framställning av natriummetall med Dangs-metoden: framställning av natriummetall genom elektrolytiskt smältning av en blandning av natriumklorid och kalciumklorid. Kalciumklorid används som flussmedel för att sänkasmältningspunkten för natriumklorid under 700 C. kalcium är mindrereducerande än natrium och introducerar inte föroreningar.
3. Natriumklorid är nödvändigt för många biologiskareaktioner. Till exempel olika lösningsformler i molekylärbiologiexperiment innehåller natriumklorid, och det mesta av bakteriekulturmedietinnehåller natriumklorid. Det är också råmaterialet i produktionen avsodaska med ammoniak-alkali-metoden.
4. Oorganiska och organiska industrier används som råmaterial för produktion av kaustik soda, klorat, hypoklorit, blekpulver, kylmedel för kylsystem, råmaterial för organisk syntes och saltningsmedel. Stålindustrin används som värmebehandlingsmedel. En värmekälla med hög temperatur används för att bilda ett saltbad med kaliumklorid, bariumklorid etc., som kan användas som ett värmemedium för att bibehålla temperaturen mellan 820-960 C. C. Dessutom används den också i glas, färgämnen, metallurgi och andra industrier.
5. Analytiska reagenser används som fluor-och kiseldioxidanalysreagenser.
6. Sodaaska produktion med Hous alkalimetod: det andra steget: ammoniumbikarbonatlösningen framställd i det första steget blandas med natriumkloridlösningen för att erhålla natriumbikarbonat ochammoniumklorid vid 10 kg C.
livsmedelsindustrin
livsmedelsindustrin och fisket används försaltning, samt råvaror för kryddor och raffinerat bordsalt.
att tillsätta salt till matlagningsrätter kan ta bort vissa luktarav råvaror och öka smaken, vilket är effekten av saltfriskhet. ”Lite smaklös, salt och smaklös” betyder detDen korrekta mängden salt kan användas för att utöva sina unika funktioner.
Medicinsk
natriumklorid är mycket viktigt för livet påjorden. De flesta biologiska vävnader innehåller flera salter. Koncentrationen av natrium i blodet är direkt relaterad till regleringen avden säkra nivån av kroppsvätskor. Ledningen av nervimpulser orsakade avsignalomvandling regleras också av natriumjoner.
vatten innehållande 0,9% natriumklorid kallas salineftersom det har samma osmotiska tryck som plasma. Normal saltlösning ärhuvudkroppsvätskesubstitut. Det används ofta vid behandling och förebyggandeav uttorkning, och det används också vid behandling av intravenös injektionoch förebyggande av hypovolemisk chock.
till skillnad från andra primater utsöndrar människor stora mängderav natriumklorid genom svettning.
natriumklorid är oumbärlig förmänniskor. Den totala mängden natriumjoner som finns hos vuxna är ca 60 g, varav 80% är i extracellulär vätska, det vill säga i plasma och intercellulärvätska. Klorid är också huvudsakligen närvarande i extracellulär vätska. Defysiologiska funktionerna hos natrium-och kloridjoner är:
(1) som upprätthåller det osmotiska trycket i den extracellulära vätskan.
(2) delta i regleringen av syra-basbalansen i kroppen.
(3) klorid är involverad i produktionen avmagsyra i kroppen. Dessutom spelar natriumklorid också en roll iupprätthålla normal excitabilitet hos nerver och muskler.
jordbruk
dess vattenlösning kan användas för utsädesval. NaCl-lösningen är konfigurerad enligt behoven hosarter, och dess densitet är större än för vatten. Frön sätts in iacl-lösning, flytande full och sjunker full.
Övrigt
enligt nya fynd som släpptes av SingaporeScience and Technology Research Institute kan natriumklorid betydligtöka hårddiskens kapacitet. Specifikt, den befintligakonventionell hårddisk använder en slumpmässigt allokerad magnetisk skivlagringteknik, som bara kan uppnå en datadensitet på 0,5 TB per kvadrattum.
den nya tekniken drar nytta av hjälp av natriumklorid. Med den nya högupplösta litografifaktortekniken kommer datadensiteten att vara mer ordnad och nå 3.3TB per kvadrattum utan behovetför komplicerade utrustningsuppgraderingar. Använda 1 TB hårddisk med dettatekniken kan nå 6 TB kapacitet utan att lägga till skivor.
- Ammoniakformel || varför ammoniak är giftigt || ammoniakförgiftning
- Varför ozonskiktet är viktigt || ozonskiktets utarmning
- vad är koncentrationen av lösningen || hur Koncentrationen påverkar reaktionen
- Varför kolcykeln är viktig || hur det fungerar
- Haloalkanes och Haloarenes NCERT Solutions || Haloalkane Structure
- Koldioxidcykel och Formel || hur koldioxid produceras
Leave a Reply