2.11: forțe intermoleculare și puncte de fierbere Relative (bp)
puncte de fierbere și puncte de topire
punctele de topire și fierbere observabile ale diferitelor molecule organice oferă o ilustrare suplimentară a efectelor interacțiunilor necovalente. Principiul general implicat este simplu: cu cât interacțiunile necovalente dintre molecule sunt mai puternice, cu atât este nevoie de mai multă energie, sub formă de căldură, pentru a le despărți. Punctele de topire și fierbere mai mari înseamnă forțe intermoleculare necovalente mai puternice.
luați în considerare punctele de fierbere ale hidrocarburilor din ce în ce mai mari. Mai mulți atomi de carbon înseamnă o suprafață mai mare posibilă pentru interacțiunea hidrofobă și, prin urmare, puncte de fierbere mai mari.
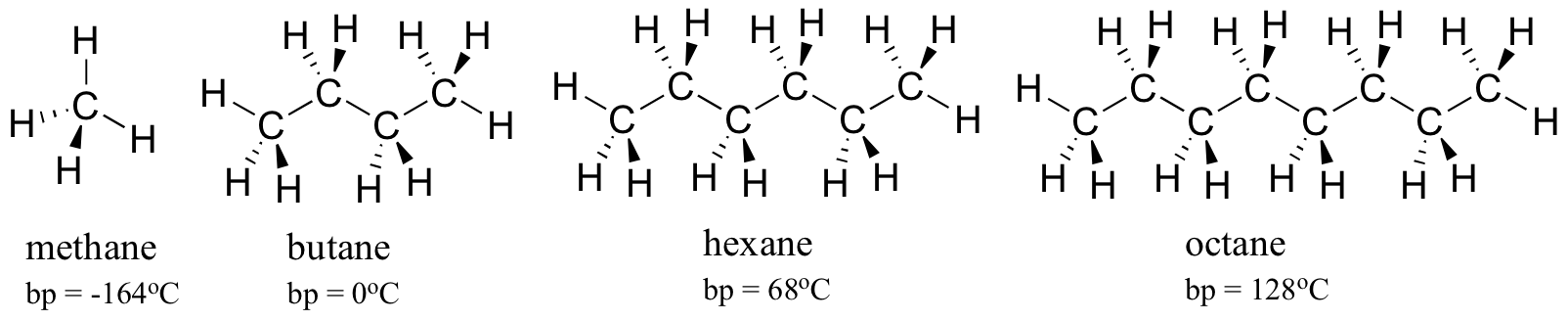
după cum v-ați aștepta, puterea legăturilor intermoleculare de hidrogen și a interacțiunilor dipol-dipol se reflectă în puncte de fierbere mai mari. Uitați-vă la tendința pentru hexan (numai interacțiunile de dispersie nepolară din Londra ), 3-hexanonă (interacțiuni dipol-dipol) și 3-hexanol (legarea hidrogenului).

un interes deosebit pentru biologi (și aproape orice altceva care este viu în univers) este efectul legăturii de hidrogen în apă. Deoarece este capabilă să formeze rețele strânse de legături intermoleculare de hidrogen, apa rămâne în faza lichidă la temperaturi de până la 100 OC (ușor mai mică la altitudine mare). Lumea ar fi, evident, un loc foarte diferit dacă apa ar fierbe la 30 OC.
exercițiu
1. Pe baza structurilor lor, clasificați fenolul, benzenul, benzaldehida și acidul benzoic în termeni de cel mai mic până la cel mai înalt punct de fierbere.
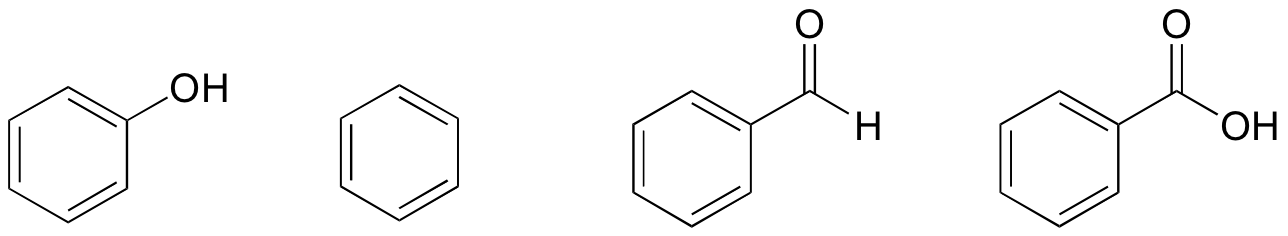
soluție
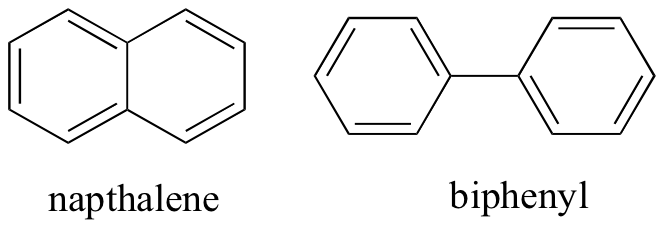
gândindu-ne la interacțiunile intermoleculare necovalente, putem prezice și punctele de topire relative. Se aplică toate aceleași principii: interacțiunile intermoleculare mai puternice au ca rezultat un punct de topire mai ridicat. Compușii ionici, așa cum era de așteptat, au de obicei puncte de topire foarte mari datorită rezistenței interacțiunilor ion-ion (există totuși unii compuși ionici care sunt lichide la temperatura camerei). Prezența grupurilor polare și, în special, de legare a hidrogenului pe compușii organici duce, în general, la puncte de topire mai mari. Forma moleculară și capacitatea unei molecule de a se împacheta strâns într-o rețea de cristal au un efect foarte mare asupra punctelor de topire. Forma plată a compușilor aromatici, cum ar fi naptalina și bifenilul, le permite să se stivuiască eficient și, prin urmare, aromele tind să aibă puncte de topire mai mari în comparație cu alcani sau alchene cu greutăți moleculare similare.
comparând punctele de topire ale benzenului și toluenului, puteți vedea că gruparea metil suplimentară pe toluen perturbă capacitatea moleculei de a stiva, scăzând astfel puterea cumulativă a forțelor de dispersie intermoleculare din Londra.
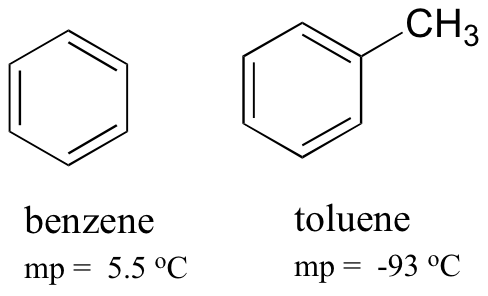
rețineți, de asemenea, că punctul de fierbere pentru toluen este de 111 oC, cu mult peste punctul de fierbere al benzenului (80 oC). Factorul cheie pentru tendința punctului de fierbere în acest caz este dimensiunea (Toluenul are încă un carbon), în timp ce pentru tendința punctului de topire, forma joacă un rol mult mai important. Acest lucru are sens atunci când considerați că topirea implică despachetarea moleculelor din matricea lor ordonată, în timp ce fierberea implică pur și simplu separarea lor de asocierea lor deja liberă (lichidă) între ele.
dacă urmați un curs de laborator organic, este posibil să fi aflat deja că impuritățile dintr-o substanță cristalină vor determina punctul de topire observat să fie mai mic în comparație cu o probă pură a aceleiași substanțe. Acest lucru se datorează faptului că impuritățile perturbă aranjamentul de ambalare ordonat al cristalului și slăbesc interacțiunile intermoleculare cumulative.

comportamentul de topire al structurilor lipidice
un exemplu biologic interesant al relației dintre structura moleculară și punctul de topire este furnizat de diferența fizică observabilă dintre grăsimile animale precum untul sau untura, care sunt solide la temperatura camerei, și uleiurile vegetale, care sunt lichide. Atât grăsimile solide, cât și uleiurile lichide se bazează pe o structură de triacilglicerol, în care trei lanțuri hidrofobe de hidrocarburi de lungime variabilă sunt atașate la o coloană vertebrală a glicerolului printr-o grupare funcțională esterică (comparați această structură cu cea a lipidelor membranare discutate în secțiunea 2.4 B).
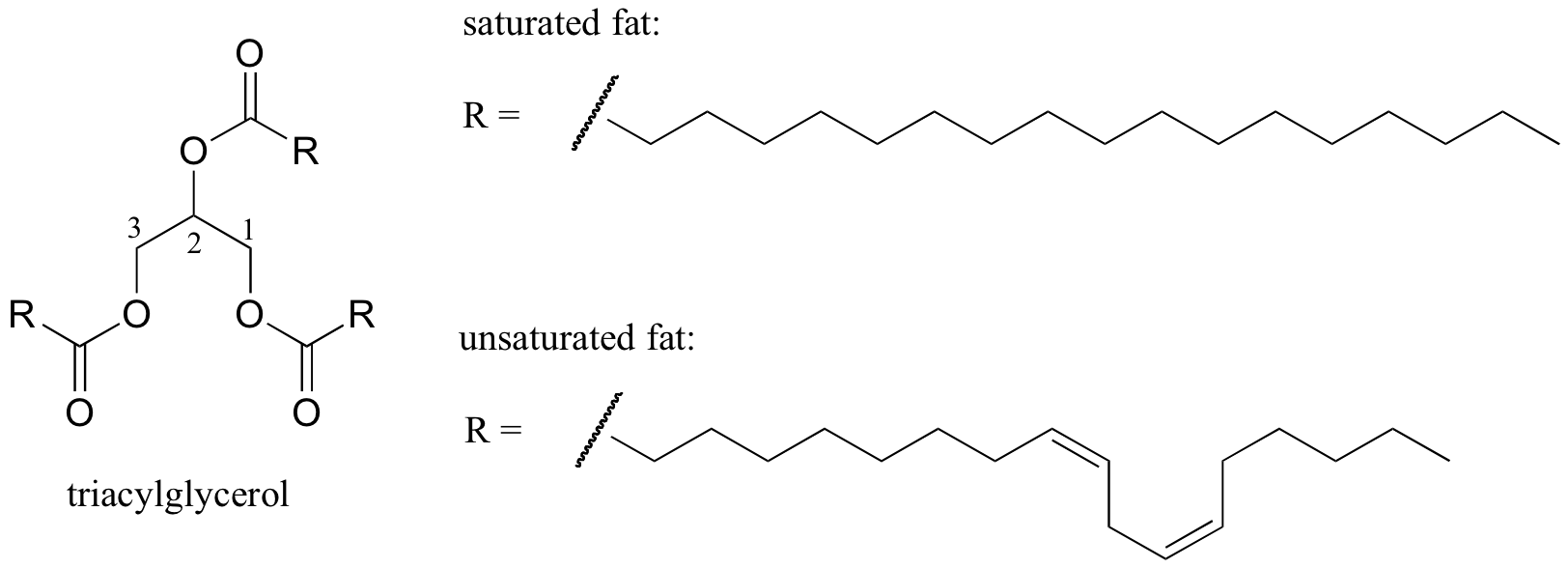
imagine 3D interactivă a unui triacilglicerol saturat (BioTopics)
saturat vs Acid gras mono-nesaturat (biotopics)
în uleiurile vegetale, lanțurile hidrofobe sunt nesaturate, ceea ce înseamnă că conțin una sau mai multe legături duble. Grăsimea animală solidă, în schimb, conține lanțuri de hidrocarburi saturate, fără legături duble. Legăturile duble din uleiurile vegetale fac ca aceste lanțuri de hidrocarburi să fie mai rigide și îndoite într-un unghi (amintiți-vă că rotația este restricționată în jurul legăturilor duble), astfel încât acestea nu se împachetează la fel de strâns și astfel pot fi rupte (adică. topit) mai ușor. Prezentat în figura de mai sus este un lanț de acizi grași polinesaturați (două legături duble) și puteți face clic pe link pentru a vedea imagini interactive ale unui acid gras saturat în comparație cu un acid gras mononesaturat (o legătură dublă).
exercițiu
2. Aranjați următorii compuși în ordinea descrescătoare a punctului de fierbere.

răspuns
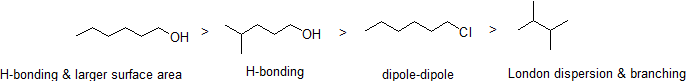
Contributors
- William Reusch, Profesor Emerit (Michigan State U.), Manual Virtual de Chimie Organică
Chimie organică cu accent biologic de Tim Soderberg (Universitatea din Minnesota, Morris)
Leave a Reply