2.11: siły międzycząsteczkowe i względne punkty wrzenia (bp)
punkty wrzenia i punkty topnienia
obserwowalne punkty topnienia i wrzenia różnych cząsteczek organicznych stanowią dodatkową ilustrację skutków oddziaływań niekowalencyjnych. Ogólna zasada jest prosta: im silniejsze niekowalencyjne interakcje między cząsteczkami, tym więcej energii jest potrzebne, w postaci ciepła, aby je rozdzielić. Wyższe temperatury topnienia i wrzenia oznaczają silniejsze niekowalencyjne siły międzycząsteczkowe.
rozważmy temperaturę wrzenia coraz większych węglowodorów. Więcej węgla oznacza większą powierzchnię możliwą do interakcji hydrofobowej, a tym samym wyższe temperatury wrzenia.
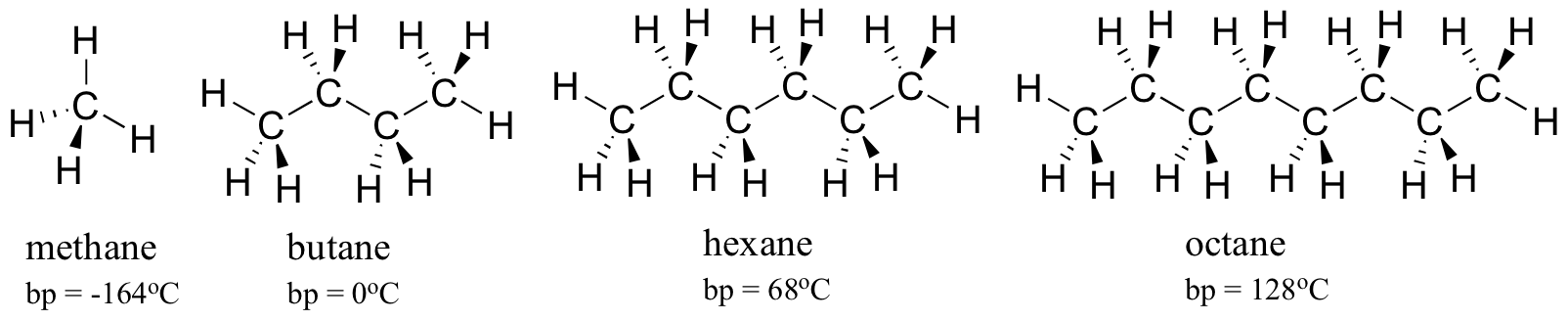
jak można się spodziewać, Siła międzycząsteczkowego wiązania wodorowego i interakcji dipol-dipol znajduje odzwierciedlenie w wyższych punktach wrzenia. Wystarczy spojrzeć na trend dla heksanu (tylko niepolarne interakcje dyspersji londyńskiej), 3-heksanonu (interakcje dipol-dipol) i 3-heksanolu (wiązanie wodorowe).

szczególnie interesujący dla biologów (i prawie wszystkiego, co żyje we wszechświecie) jest efekt wiązania wodorowego w wodzie. Ponieważ jest w stanie tworzyć ciasne sieci międzycząsteczkowych wiązań wodorowych, woda pozostaje w fazie ciekłej w temperaturze do 100 OC (nieco niższej na dużych wysokościach). Świat byłby oczywiście zupełnie inny, gdyby woda gotowała się w temperaturze 30 OC.
ćwiczenia
1. W oparciu o ich struktury, rangi fenol, benzen, benzaldehyd i kwas benzoesowy pod względem najniższej do najwyższej temperatury wrzenia.
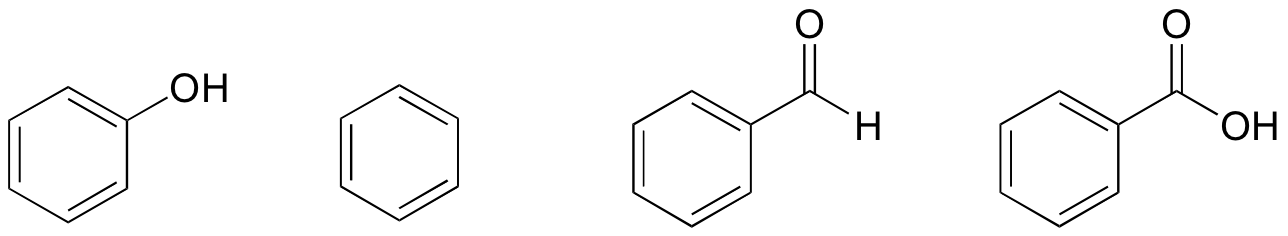
rozwiązanie
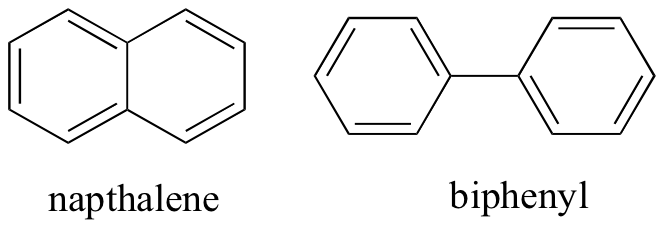
myśląc o niekowalencyjnych interakcjach międzycząsteczkowych, możemy również przewidzieć względne temperatury topnienia. Wszystkie te same zasady mają zastosowanie: silniejsze interakcje międzycząsteczkowe powodują wyższą temperaturę topnienia. Związki jonowe, zgodnie z oczekiwaniami, zwykle mają bardzo wysoką temperaturę topnienia ze względu na siłę oddziaływań jonowo-jonowych (istnieją jednak pewne związki jonowe, które są cieczami w temperaturze pokojowej). Obecność grup polarnych, a zwłaszcza wiązań wodorowych na związkach organicznych prowadzi na ogół do wyższych temperatur topnienia. Kształt cząsteczkowy i zdolność cząsteczki do szczelnego pakowania się w siatkę krystaliczną ma bardzo duży wpływ na punkty topnienia. Płaski kształt związków aromatycznych, takich jak naptalen i bifenyl, pozwala im skutecznie łączyć się ze sobą, a zatem aromaty mają wyższe temperatury topnienia w porównaniu do alkanów lub alkenów o podobnej masie cząsteczkowej.
porównując temperaturę topnienia benzenu i toluenu, można zauważyć, że dodatkowa grupa metylowa na toluenie zakłóca zdolność cząsteczki do układania się, zmniejszając w ten sposób skumulowaną siłę międzycząsteczkowych sił dyspersji londyńskiej.
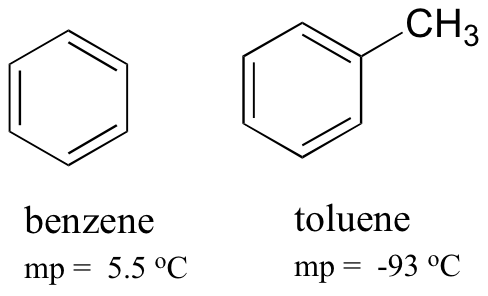
zwróć również uwagę, że temperatura wrzenia toluenu wynosi 111 oC, znacznie powyżej temperatury wrzenia benzenu (80 oC). Kluczowym czynnikiem dla trendu temperatury wrzenia w tym przypadku jest wielkość (toluen ma jeszcze jeden węgiel), podczas gdy dla trendu temperatury topnienia kształt odgrywa znacznie ważniejszą rolę. Ma to sens, gdy weźmiemy pod uwagę, że topienie polega na „rozpakowaniu” cząsteczek z ich uporządkowanego układu, podczas gdy gotowanie polega po prostu na oddzieleniu ich od ich już luźnego (płynnego) związku ze sobą.
Jeśli bierzesz kurs laboratorium organicznego, być może już wiesz, że zanieczyszczenia w substancji krystalicznej spowodują, że obserwowana temperatura topnienia będzie niższa w porównaniu do czystej próbki tej samej substancji. Dzieje się tak dlatego, że zanieczyszczenia zakłócają uporządkowany układ pakowania Kryształu i sprawiają, że skumulowane interakcje międzycząsteczkowe są słabsze.

zachowanie topnienia struktur lipidowych
ciekawy biologiczny przykład związku między strukturą molekularną a temperaturą topnienia zapewnia obserwowalna fizyczna różnica między tłuszczami zwierzęcymi, takimi jak masło lub smalec, które są stałe w temperaturze pokojowej, a olejami roślinnymi, które są płynne. Zarówno tłuszcze stałe, jak i płynne oleje są oparte na strukturze „triacyloglicerolu”, w której trzy hydrofobowe łańcuchy węglowodorowe o różnej długości są przyłączone do szkieletu glicerolu przez estrową grupę funkcyjną (porównaj tę strukturę z strukturą lipidów błonowych omówioną w sekcji 2.4 B).
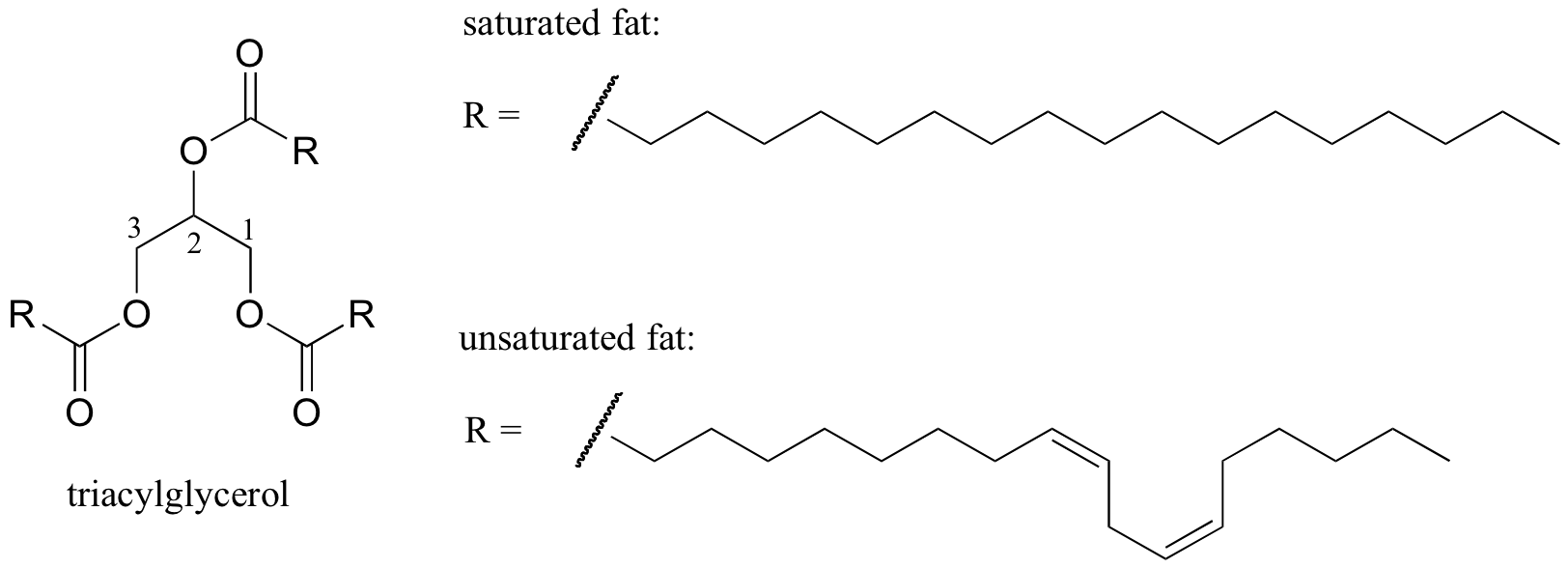
interaktywny obraz 3D nasyconego triacyloglicerolu (Biotopik)
nasycony vs mono-nienasycony kwas tłuszczowy (Biotopik)
w olejach roślinnych łańcuchy hydrofobowe są nienasycone, co oznacza, że zawierają jedno lub więcej podwójnych wiązań. Natomiast stały tłuszcz zwierzęcy zawiera nasycone łańcuchy węglowodorowe, bez podwójnych wiązań. Podwójne wiązania w olejach roślinnych powodują, że te łańcuchy węglowodorowe są bardziej sztywne i „wygięte” pod kątem (pamiętaj, że obrót jest ograniczony wokół podwójnych wiązań), w wyniku czego nie łączą się tak ściśle, a tym samym mogą zostać rozerwane (tj. stopiony) łatwiej. Na powyższym rysunku przedstawiono wielonienasycony łańcuch kwasów tłuszczowych (dwa wiązania podwójne) i można kliknąć na link, aby zobaczyć interaktywne obrazy nasyconego kwasu tłuszczowego w porównaniu do jednonienasyconego kwasu tłuszczowego (jedno wiązanie podwójne).
ćwiczenia
2. Ułóż następujące związki w kolejności malejącej temperatury wrzenia.

odpowiedź
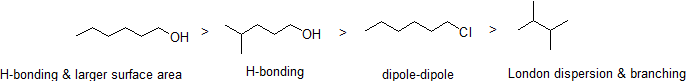
autorzy
- William Reusch, Emerytowany profesor (Michigan State U.), Wirtualny Podręcznik Chemii Organicznej
Chemia organiczna z biologicznym naciskiem Tima Soderberga (University of Minnesota, Morris)
Leave a Reply