2.11: Mezimolekulární Síly A Relativní Body Varu (bp)
body Varu a tání
pozorovatelného tání a body varu různých organických molekul poskytuje další ilustrace účinků noncovalent interactions. Zastřešující princip je jednoduchý: čím silnější noncovalent interakce mezi molekulami, tím více energie, která je nutná, ve formě tepla, rozbít je od sebe. Vyšší teploty tání a varu znamenají silnější nekovalentní mezimolekulární síly.
zvažte body varu stále větších uhlovodíků. Více uhlíků znamená větší možnou plochu povrchu pro hydrofobní interakci, a tedy vyšší body varu.
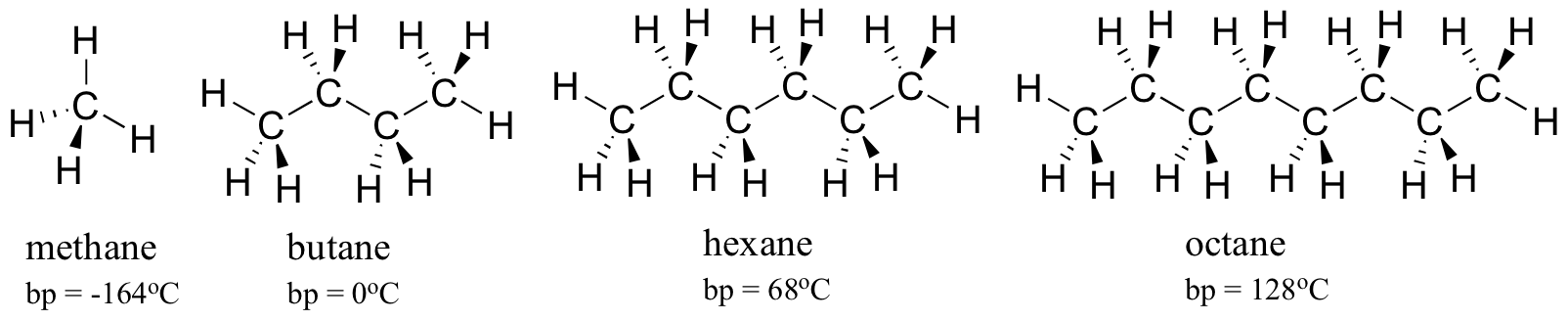
jak byste očekávali, síla mezimolekulární vodíkové vazby a interakce dipól-dipól se odráží ve vyšších bodech varu. Stačí se podívat na trend hexanu (pouze nepolární disperzní interakce), 3-hexanonu (interakce dipól-dipól) a 3-hexanolu(vodíková vazba).

zvláště zajímavý pro biology (a téměř cokoli jiného, co je ve vesmíru živé), je účinek vodíkové vazby ve vodě. Protože je schopen vytvářet těsné sítě mezimolekulárních vodíkových vazeb, zůstává voda v kapalné fázi při teplotách do 100 OC (mírně nižší ve vysoké nadmořské výšce). Svět by byl zjevně velmi odlišným místem, kdyby se voda vařila 30 OC.
cvičení
1. Na základě jejich struktur řadí fenol, benzen, benzaldehyd a kyselinu benzoovou z hlediska nejnižší až nejvyšší teploty varu.
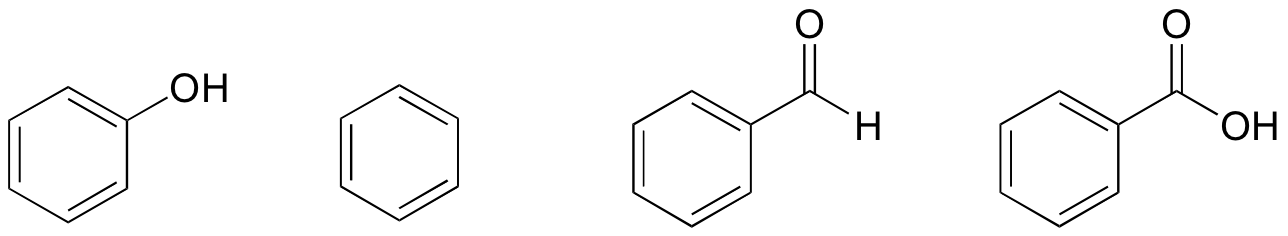
řešení
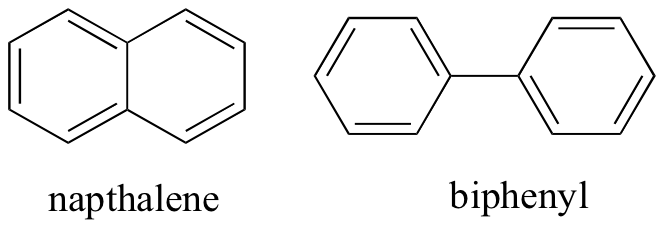
přemýšlením o nekovalentních intermolekulárních interakcích můžeme také předpovědět relativní body tání. Platí všechny stejné principy: silnější intermolekulární interakce vedou k vyšší teplotě tání. Iontové sloučeniny, jak se očekávalo, mají obvykle velmi vysoké teploty tání v důsledku síly iontových interakcí (existují však některé iontové sloučeniny, které jsou kapalinami při pokojové teplotě). Přítomnost polárních a zejména vodíkových vazebných skupin na organických sloučeninách obecně vede k vyšším bodům tání. Molekulární tvar a schopnost molekuly pevně zabalit do krystalové mřížky má velmi velký vliv na body tání. Plochý tvar aromatických sloučenin, jako jsou napthalene a bifenyl jim umožňuje, aby zásobník spolu efektivně, a tak aromátů mají vyšší body tání ve srovnání s alkanů nebo alkenů s podobnou molekulovou hmotností.
Porovnání tání benzenu a toluenu, můžete vidět, že extra methylová skupina na toluenu narušuje molekuly je schopnost na stack, tedy snížení souhrnné síly mezimolekulární Londýně disperzní síly.
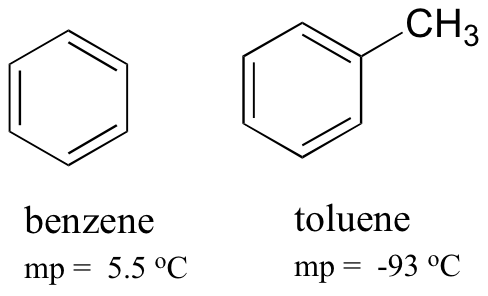
Všimněte si také, že teplota varu pro toluen je 111 oC, výrazně nad bodem varu benzenu (80 oC). Klíčovým faktorem pro trend bodu varu je v tomto případě velikost (toluen má ještě jeden uhlík), zatímco pro trend bodu tání hraje tvar mnohem důležitější roli. To dává smysl, když si uvědomíte, že tání zahrnuje ‚rozbalení‘ molekul z jejich seřazeném poli, vzhledem k tomu, vroucí zahrnuje jednoduše oddělovat je od jejich již volné (kapalina) sdružení s ostatními.
Jestliže užíváte organické laboratoři samozřejmě, můžete se už naučili, že nečistoty v krystalická látka způsobí, že pozorovaný bod tání je nižší ve srovnání s čistý vzorek ze stejné látky. Je to proto, že nečistoty narušit objednané balení uspořádání krystalu, a aby kumulativní mezimolekulární interakce slabší.

tání chování lipidových struktur
zajímavý biologický příklad vztahu mezi molekulární strukturou a bod tání je poskytována pozorovatelný fyzický rozdíl mezi živočišné tuky, jako je máslo nebo sádlo, které jsou pevné při pokojové teplotě, a rostlinné oleje, které jsou kapalné. Jak pevné tuky a kapalné oleje jsou založeny na ‚triacylglycerolu strukturu, kde tři hydrofobní uhlovodíkové řetězce různé délky jsou připojené na glycerol páteře prostřednictvím esterové funkční skupiny (porovnejte tuto strukturu membrány lipidy popsány v kapitole 2.4. B).
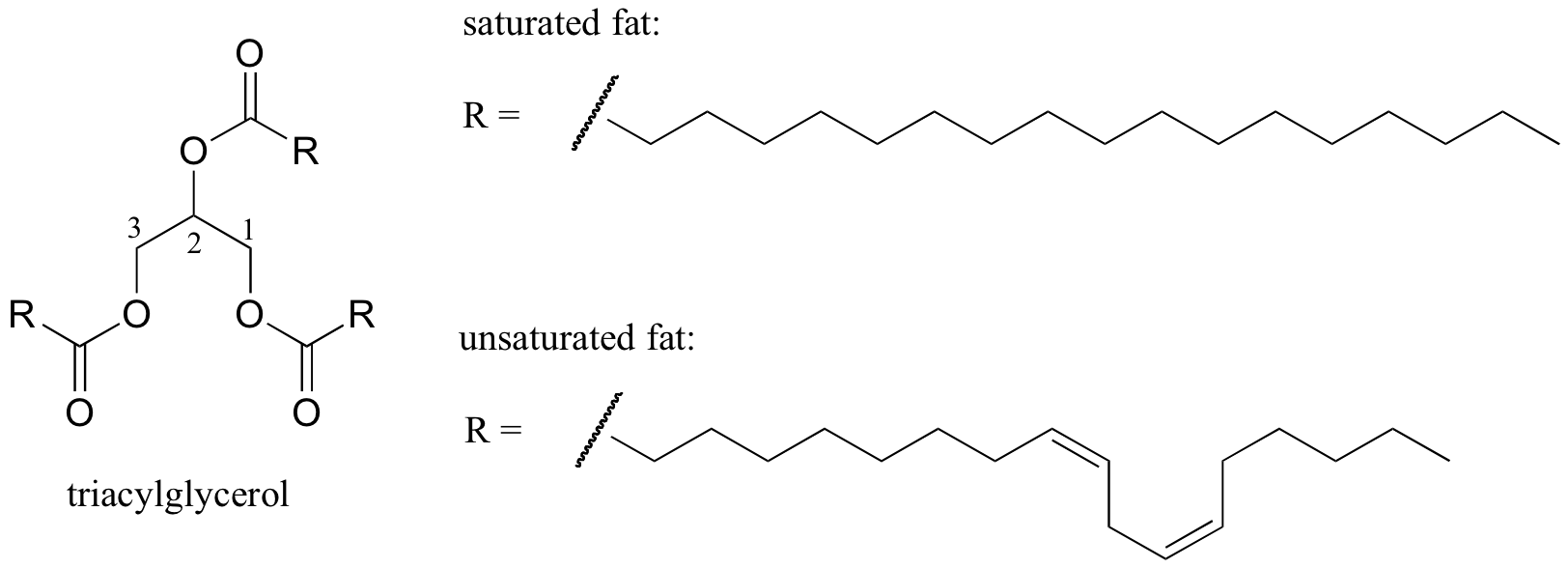
Interaktivní 3D obraz nasycených triacylglycerolů (BioTopics)
Syté vs mono-nenasycené mastné kyseliny (BioTopics)
V rostlinných olejích, hydrofobní řetězce jsou nenasycené, to znamená, že obsahují jednu nebo více dvojných vazeb. Pevný živočišný tuk naopak obsahuje nasycené uhlovodíkové řetězce bez dvojných vazeb. Dvojné vazby v rostlinných olejích způsobují, že tyto uhlovodíkové řetězce jsou tužší a „ohnuté“ pod úhlem (pamatujte, že rotace je omezena kolem dvojných vazeb), což má za následek, že se tak těsně nezabalují, a proto je lze rozdělit (tj. tavený) snadněji. Na obrázku výše je zobrazen řetězec polynenasycených mastných kyselin (dvě dvojné vazby) a kliknutím na odkaz zobrazíte interaktivní obrázky nasycené mastné kyseliny ve srovnání s mononenasycenou mastnou kyselinou (jedna dvojná vazba).
cvičení
2. Uspořádejte následující sloučeniny v pořadí podle klesající teploty varu.

odpověď
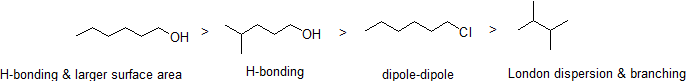
přispěvatelé
- William Reusch, Emeritní profesor (Michigan State u.), Virtuální Učebnice Organické Chemie
Organické Chemie S Biologickou Důraz Tim Soderberg (University of Minnesota Morris)
Leave a Reply