Isotopi: 13C
Isotopomeri
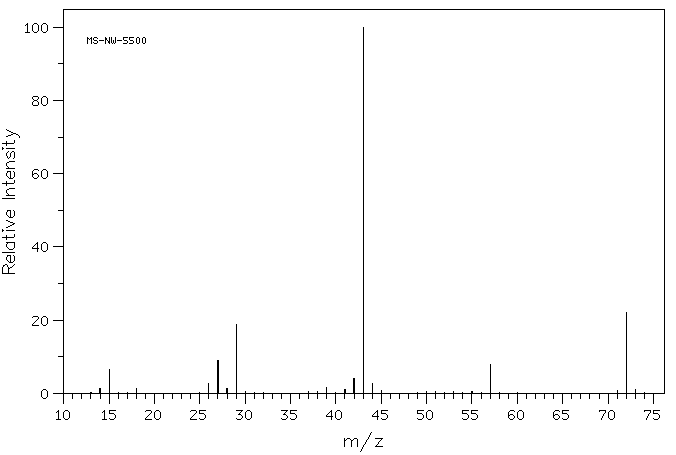
Se si guarda da vicino lo spettro di massa di un composto organico, 2-butanone, si vede una linea a m/z 72, che corrisponde a 4 carboni, un ossigeno e 8 idrogeni.
- Di solito, i numeri interi vengono utilizzati per i pesi molecolari in spettrometria di massa.
- Le masse atomiche nella tavola periodica, fuori a 4 cifre decimali, sono le masse medie tra cui diversi isotopi possibili.
- Poiché la spettrometria di massa esamina le singole molecole, sono necessarie singole masse atomiche, non quelle medie. Di solito questo significa usare un numero intero.
Inoltre, ci sono un certo numero di altre linee a valori inferiori di m/z; queste corrispondono alle masse di pezzi più piccoli di quelle molecole di 2-butanone che si sfaldano durante l’esperimento. Non guarderemo troppo da vicino come si presentano fino a quando non arriveremo a reazioni radicali più avanti nel corso. Tuttavia, vedremo alcuni fattori che rendono i cationi stabili più avanti in questo capitolo.
Se osservi da vicino lo spettro di massa del 2-butanone, vedrai anche un altro piccolo picco a m / z 73. Questo è indicato come il picco M+1 (uno maggiore dello ion molecolare), e sorge a causa di 13C. Questo composto è indicato come un isotopomero; ciò significa che lo stesso composto con un isotopo diverso.
- 12C è circa il 99% abbondante; il 99% degli atomi di carbonio ha una massa di 12 amu.
- 13C è circa l ‘1% abbondante; l’ 1% degli atomi di carbonio ha una massa di 13 amu.
- I composti che contengono un atomo di 13C hanno una massa maggiore del previsto.
La possibilità che una molecola in un campione contenga un atomo di 13C è correlata al numero di carboni presenti. Se c’è solo un atomo di carbonio nella molecola, ha una probabilità dell ‘ 1% di essere un 13C. Ciò significa che il picco M+1 sarebbe solo 1/100th alto come M+, il picco per lo ion molecolare.
- Il picco M+1 da un atomo 13C è molto piccolo.
- Più carboni ci sono in una molecola, più grande è il picco M+1.
- Se ci sono 10 atomi di carbonio nella molecola, c’è una probabilità del 10% che un atomo 13C sia presente. Il picco M+1 è circa 1/10 della dimensione del picco M+.
- Se ci sono 100 carboni nella molecola, c’è una buona probabilità che sia presente un atomo 13C. A quel punto, il picco M+1 è in realtà molto più grande del M+. picco
Leave a Reply