Isotopes: 13C
Isotopomères
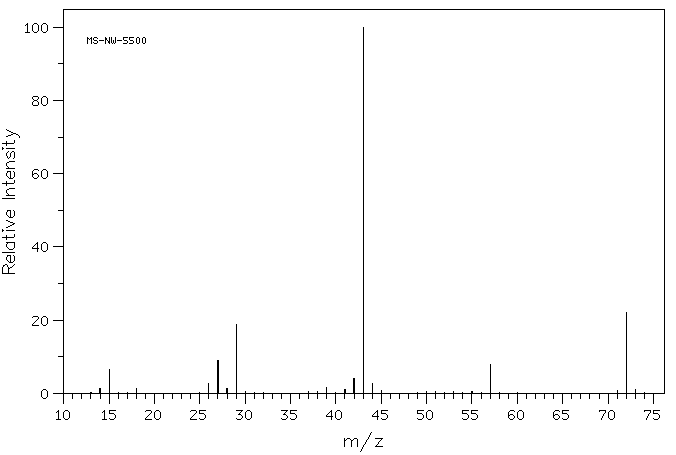
Si vous regardez de près le spectre de masse d’un composé organique, la 2-butanone, vous voyez une raie à m / z 72, ce qui correspond à 4 carbones, un oxygène et 8 hydrogènes.
- Habituellement, les nombres entiers sont utilisés pour les poids moléculaires en spectrométrie de masse.
- Les masses atomiques du tableau périodique, à 4 décimales près, sont les masses moyennes, y compris les différents isotopes possibles.
- Parce que la spectrométrie de masse examine des molécules individuelles, des masses atomiques individuelles sont nécessaires, pas des masses moyennes. Habituellement, cela signifie utiliser un nombre entier.
En outre, il existe un certain nombre d’autres raies à des valeurs inférieures de m / z; celles-ci correspondent aux masses de plus petits morceaux de ces molécules de 2-butanone qui se désagrègent pendant l’expérience. Nous ne regarderons pas de trop près comment ceux-ci surviennent jusqu’à ce que nous arrivions à des réactions radicales plus tard dans le cours. Cependant, nous examinerons certains facteurs qui rendent les cations stables plus loin dans ce chapitre.
Si vous regardez de près le spectre de masse de la 2-butanone, vous verrez également un autre petit pic à m/z 73. C’est ce qu’on appelle le pic M + 1 (un plus grand que l’ion moléculaire), et cela se produit à cause du 13C. Ce composé est appelé isotopomère; cela signifie le même composé avec un isotope différent.
- Le 12C est abondant à environ 99%; 99% des atomes de carbone ont une masse de 12 amu.
- Le 13C est abondant d’environ 1%; 1% des atomes de carbone ont une masse de 13 amu.
- Les composés qui contiennent un atome de 13C ont une masse plus grande que prévu.
La probabilité qu’une molécule dans un échantillon contienne un atome de 13C est liée au nombre de carbones présents. S’il n’y a qu’un seul atome de carbone dans la molécule, il a 1% de chance d’être un 13C. Cela signifie que le pic M + 1 ne serait que de 1 / 100e de plus que M +, le pic de l’ion moléculaire.
- Le pic M+1 d’un atome 13C est très petit.
- Plus il y a de carbones dans une molécule, plus le pic M+1 est grand.
- S’il y a 10 atomes de carbone dans la molécule, il y a 10% de chances qu’un atome 13C soit présent. Le pic M+1 est d’environ 1 / 10ème de la taille du pic M+.
- S’il y a 100 carbones dans la molécule, il y a de très fortes chances qu’un atome 13C soit présent. À ce stade, le pic M + 1 est en fait beaucoup plus grand que le M +. pic
Leave a Reply