isotopen: 13C
Isotopomeren
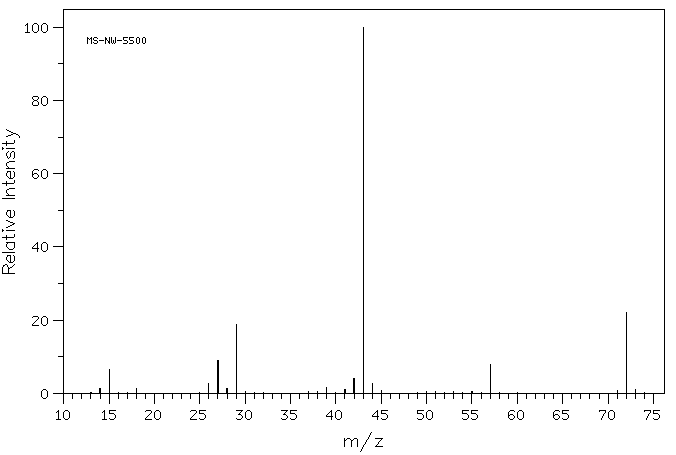
als je goed kijkt naar het massaspectrum van een organische verbinding, 2-butanon, zie je een lijn op m/z 72, die overeenkomt met 4 koolstofatomen, een zuurstof en 8 waterstofatomen.
- gewoonlijk worden hele getallen gebruikt voor molecuulgewichten in massaspectrometrie.
- de atoommassa ’s in het periodiek systeem, tot op 4 decimalen, zijn de gemiddelde massa’ s inclusief verschillende mogelijke isotopen.omdat massaspectrometrie individuele moleculen onderzoekt, zijn individuele atoommassa ‘ s nodig, niet gemiddelde. Meestal betekent dat het gebruik van een heel getal.
bovendien zijn er een aantal andere lijnen met lagere waarden van m / z; deze komen overeen met de massa ‘ s van kleinere stukken van die 2-butanonmoleculen die tijdens het experiment uiteenvallen. We zullen niet te goed kijken naar hoe die ontstaan totdat we later in de cursus tot radicale reacties komen. Echter, we zullen kijken naar een aantal factoren die kationen stabiel later in dit hoofdstuk te maken.
als je goed kijkt naar het massaspectrum van 2-butanon, zie je ook nog een kleine piek op m / z 73. Dit wordt bedoeld als de M+1 piek (één groter dan het moleculaire ion), en het ontstaat wegens 13C. deze verbinding wordt bedoeld als een isotopomeer; dat betekent dezelfde verbinding met een andere isotoop.
- 12C is ongeveer 99% in overvloed; 99% van de koolstofatomen heeft een massa van 12 amu.
- 13C is ongeveer 1% in overvloed; 1% van de koolstofatomen heeft een massa van 13 amu.
- verbindingen die een 13C-atoom bevatten, hebben een massa groter dan verwacht.
de kans dat een molecuul in een monster een 13C-atoom bevat is gerelateerd aan het aantal aanwezige koolstoffen. Als er maar één koolstofatoom in het molecuul zit, heeft het 1% kans om een 13C te zijn. dat betekent dat de M+1 piek slechts 1/100e zo hoog is als M+, de piek voor het moleculaire ion.
- De M + 1-piek van een 13C-atoom is zeer klein.
- Hoe meer koolstof in een molecuul zit, hoe groter de M+1 piek.
- als er 10 koolstofatomen in het molecuul zitten, is er een kans van 10% dat er een 13C-atoom aanwezig is. De M+ 1 piek is ongeveer 1/10e de grootte van de M + piek.
- als er 100 koolstofatomen in het molecuul zitten, is er een zeer goede kans dat er een 13C-atoom aanwezig is. Op dat moment is de M+1 piek eigenlijk veel groter dan de M+. piek
Leave a Reply