isótopos: 13C
Isotopómeros
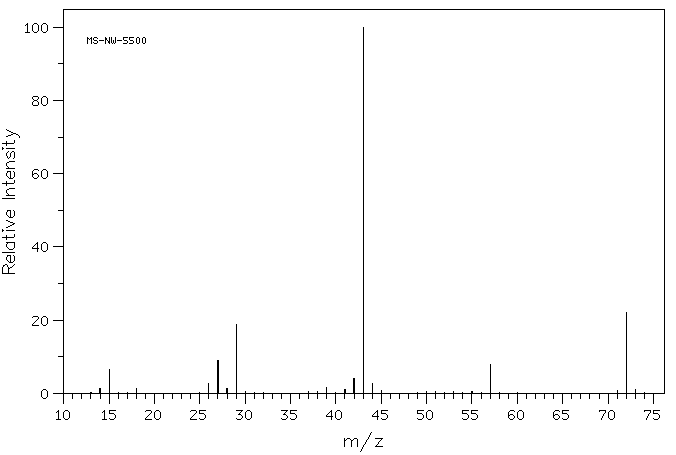
Se olharmos atentamente para o espectro de massa de um composto orgânico, 2-butanona, vemos uma linha em m/z 72, que corresponde a 4 carbonos, um oxigénio e 8 hidrogénios.
- Usually, whole numbers are used for molecular weights in mass spectrometry.
- as massas atómicas da tabela periódica, até 4 casas decimais, são as massas médias, incluindo diferentes isótopos possíveis.
- Porque a espectrometria de massa examina moléculas individuais, massas atômicas individuais são necessárias, não as médias. Normalmente isso significa usar um número inteiro.
além disso, há uma série de outras linhas com valores mais baixos de m/z; estas correspondem às massas de pedaços menores dessas moléculas de 2-butanona que se desfazem durante o experimento. Não vamos olhar muito de perto como esses surgem até que cheguemos a reações radicais mais tarde no curso. No entanto, vamos olhar para alguns fatores que tornam cations estáveis mais tarde neste capítulo.se olhar atentamente para o espectro de massa de 2-butanona, verá também outro pequeno pico em m/z 73. Isto é referido como o pico M+1 (um maior que o ião molecular), e surge por causa de 13C. este composto é referido como um isótopo; isso significa o mesmo composto com um isótopo diferente.
- 12C é cerca de 99% abundante; 99% dos átomos de carbono têm uma massa de 12 amu.
- 13C é cerca de 1% abundante; 1% dos átomos de carbono têm uma massa de 13 amu.compostos que contêm um átomo de 13C têm uma massa maior do que o esperado.
a possibilidade de uma molécula numa amostra conter um átomo de 13C está relacionada com o número de carbonos presentes. Se houver apenas um átomo de carbono na molécula, ele tem uma chance de 1% de ser um 13C. isso significa que o pico M+1 seria apenas 1/100th como m+, o pico para o íon molecular.
- O pico m+1 de um átomo de 13C é muito pequeno.
- Quanto mais carbonos há em uma molécula, maior o pico M+1.se há 10 átomos de carbono na molécula, há 10% de probabilidade de um átomo de 13C estar presente. O pico M+1 é cerca de 1/10 do tamanho do Pico M+.
- Se existem 100 carbonos na molécula, há uma grande chance de que um átomo de 13C esteja presente. Nesse ponto, o pico M+1 é realmente muito maior que o m+. pico
Leave a Reply