Isótopos: 13C
Isotopómeros
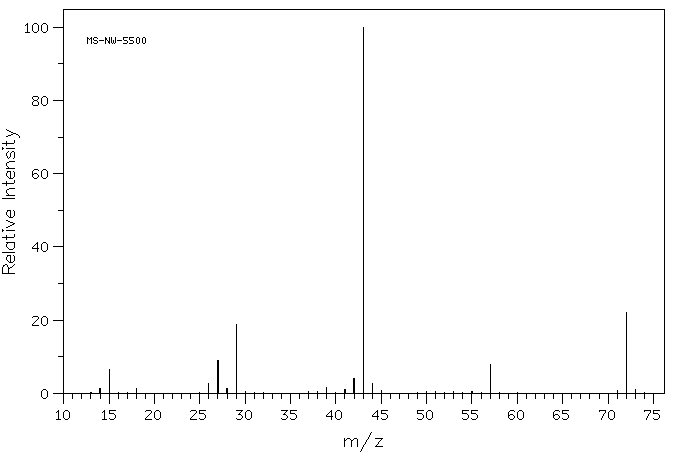
Si observa de cerca el espectro de masa de un compuesto orgánico, la 2-butanona, verá una línea en m/z 72, que corresponde a 4 carbonos, un oxígeno y 8 hidrógenos.
- Generalmente, los números enteros se utilizan para pesos moleculares en espectrometría de masas.
- Las masas atómicas en la tabla periódica, con 4 decimales, son las masas medias que incluyen diferentes isótopos posibles.
- Debido a que la espectrometría de masas examina moléculas individuales, se necesitan masas atómicas individuales, no medias. Por lo general, eso significa usar un número entero.
Además, hay una serie de otras líneas a valores más bajos de m / z; estas corresponden a las masas de piezas más pequeñas de esas moléculas de 2-butanona que se rompen durante el experimento. No veremos muy de cerca cómo surgen hasta que lleguemos a reacciones radicales más adelante en el curso. Sin embargo, veremos algunos factores que hacen que los cationes sean estables más adelante en este capítulo.
Si observa de cerca el espectro de masa de la 2-butanona, también verá otro pequeño pico en m/z 73. Esto se conoce como el pico M+1 (uno mayor que el ion molecular), y surge debido a 13C. Este compuesto se conoce como isotopómero; eso significa el mismo compuesto con un isótopo diferente.
- El 12C es aproximadamente un 99% abundante; el 99% de los átomos de carbono tienen una masa de 12 uma.
- El 13C es aproximadamente un 1% abundante; el 1% de los átomos de carbono tienen una masa de 13 uma.
- Los compuestos que contienen un átomo de 13C tienen una masa mayor de la esperada.
La posibilidad de que una molécula de una muestra contenga un átomo de 13C está relacionada con el número de carbonos presentes. Si solo hay un átomo de carbono en la molécula, tiene un 1% de probabilidad de ser un 13C. Eso significa que el pico M+1 sería solo 1/100 de la altura de M+, el pico para el ion molecular.
- El pico M+1 de un átomo de 13C es muy pequeño.
- Cuantos más carbonos haya en una molécula, mayor será el pico M+1.
- Si hay 10 átomos de carbono en la molécula, hay un 10% de probabilidad de que esté presente un átomo de 13C. El pico M+1 es aproximadamente 1/10 del tamaño del pico M+.
- Si hay 100 carbonos en la molécula, hay una muy buena probabilidad de que esté presente un átomo de 13C. En ese punto, el pico M+1 es en realidad mucho más grande que el M+. pico
Leave a Reply