Isotope: 13C
Isotopomere
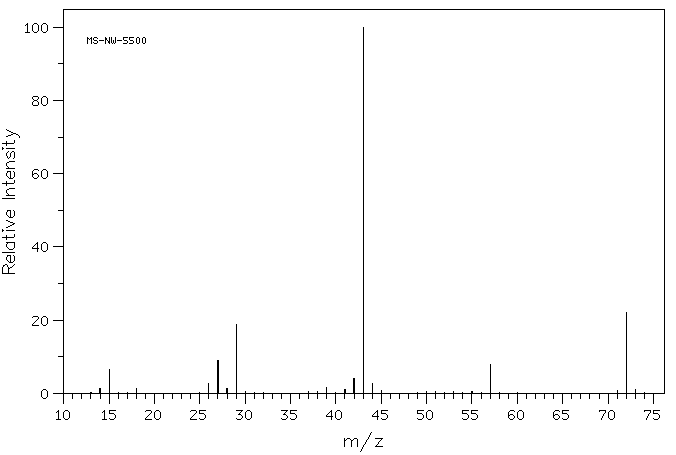
Wenn Sie sich das Massenspektrum einer organischen Verbindung, 2-Butanon, genau ansehen, sehen Sie eine Linie bei m / z 72, die 4 Kohlenstoffen, einem Sauerstoff und 8 Wasserstoffatomen entspricht.
- Normalerweise werden ganze Zahlen für Molekulargewichte in der Massenspektrometrie verwendet.
- Die Atommassen im Periodensystem sind bis auf 4 Dezimalstellen die durchschnittlichen Massen einschließlich verschiedener möglicher Isotope.
- Da die Massenspektrometrie einzelne Moleküle untersucht, werden einzelne Atommassen benötigt, keine durchschnittlichen. Normalerweise bedeutet das, eine ganze Zahl zu verwenden.
Darüber hinaus gibt es eine Reihe weiterer Linien bei niedrigeren Werten von m/ z; Diese entsprechen den Massen kleinerer Stücke jener 2-Butanonmoleküle, die während des Experiments auseinanderfallen. Wir werden nicht zu genau hinschauen, wie diese entstehen, bis wir später im Kurs zu radikalen Reaktionen kommen. Wir werden jedoch später in diesem Kapitel einige Faktoren betrachten, die Kationen stabil machen.
Wenn Sie sich das Massenspektrum von 2-Butanon genau ansehen, sehen Sie auch einen weiteren kleinen Peak bei m / z 73. Dies wird als M + 1-Peak (einer größer als das Molekülion) bezeichnet und entsteht aufgrund von 13C. Diese Verbindung wird als Isotopomer bezeichnet; das bedeutet die gleiche Verbindung mit einem anderen Isotop.
- 12C ist zu etwa 99% reichlich vorhanden; 99% der Kohlenstoffatome haben eine Masse von 12 amu.
- 13C ist etwa 1% reichlich vorhanden; 1% der Kohlenstoffatome haben eine Masse von 13 amu.
- Verbindungen, die ein 13C-Atom enthalten, haben eine größere Masse als erwartet.
Die Wahrscheinlichkeit, dass ein Molekül in einer Probe ein 13C-Atom enthält, hängt von der Anzahl der vorhandenen Kohlenstoffe ab. Wenn es nur ein Kohlenstoffatom im Molekül gibt, hat es eine 1% ige Chance, ein 13C zu sein. Das bedeutet, dass der M + 1-Peak nur 1/100 so groß wäre wie M +, der Peak für das Molekülion.
- Der M+1-Peak eines 13C-Atoms ist sehr klein.
- Je mehr Kohlenstoffe in einem Molekül vorhanden sind, desto größer ist der M+1-Peak.
- Wenn das Molekül 10 Kohlenstoffatome enthält, besteht eine 10% ige Chance, dass ein 13C-Atom vorhanden ist. Der M + 1-Peak ist etwa 1/10 der Größe des M + -Peaks.
- Wenn das Molekül 100 Kohlenstoffatome enthält, besteht eine sehr gute Chance, dass ein 13C-Atom vorhanden ist. An diesem Punkt ist der M + 1-Peak tatsächlich viel größer als der M+. spitze
Leave a Reply