Hidrogénionok koncentrációja

ezután felmerül a kérdés, hogy mi határozza meg az oldat savasságát vagy lúgosságát.
valójában a hidrogénionok koncentrációja, az oldatban lévő hidrogénionok százalékos aránya határozza meg.
vegyük példaként a vizet.
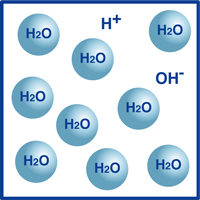
mint tudják, a víz képlete H2O. a vízben lévő molekulák többsége olyan rendkívül stabil formában van, amelyet H2O-nak ismerünk.
ezeknek a molekuláknak azonban nagyon kis százaléka bontott fel hidrogénionokra (H+) és hidroxidionokra (OH -), amint azt az ábra szemlélteti.
valójában ez a hidrogénionok és hidroxidionok egyensúlya határozza meg a víz pH-ját.
amikor a hidrogénionok meghaladják a hidroxidionokat, az oldat savas. Ha a fordított igaz, akkor az oldat lúgos.
Ha a hőmérséklet nem változik, a következő összefüggés a hidrogénionok (H+) és a hidroxidionok (Oh -) sűrűsége között bármilyen oldattal megtalálható:
=Kw=10-14(=rögzített) 25℃
(Kw a víz ionterméke vagy a víz disszociációs állandója.)
tiszta vízben vagy semleges oldatban a következő képlet igaz, mert
=,
==√(Kw)=√10-14 = 10-7
ha ismeri bármelyik értékét, vagy megtalálhatja a másik értékét.
így csak mérjük, és standardként használjuk a pH-ra. ily módon a pH-t hidrogén-ion koncentráció határozza meg.

tehát a pH-t a következő képlet határozza meg:
pH = – log10
a hidrogénionok koncentrációja minden olyan oldatban, amellyel valószínűleg találkozunk, 1 mol-tól 0, 000001 mol-ig terjedhet liter oldatonként. A rendkívül alacsony hidrogén-ion koncentrációjú oldatok azonban elképzelhető, hogy a tizedespont után elég hosszú nullákat állíthatnak fel. S. P. L. Sorensen Dán biokémikus volt az első, aki a ma ismert pH-rendszert használta, amely a közös logaritmusban a hidrogén-ion koncentráció inverz számát pH-ként határozza meg. Ez azt jelenti, hogy
pH=-log10
semleges oldat esetén
=10-7, amelyet 7 pH-nak nevezünk.
Ez például azt jelenti, hogy egy 4 pH-értékű oldat hidrogén-ion koncentrációja 10-4mol / l, ami azt jelenti, hogy 0,0001 mol hidrogénionokat tartalmaz 1 literes oldatban. Ugyanígy az 5-ös pH-értékű oldat 10-5mol/l hidrogénionokat tartalmaz, a 6-os pH-értékű oldat 10-6mol/l hidrogénionokat tartalmaz, míg a 7-es pH-értékű oldat 10-7mol/l hidrogénionokat tartalmaz. Észre fogja venni, hogy ha összehasonlítja az oldatokat a 4-es pH-val, a 7-es pH-val, akkor a pH-különbség csak 3, de a 7-es pH-értékű hidrogénionok koncentrációja 1000-szer olyan magas, mint a 4-es pH-értéknél.A következő ábra az exponensek előnyeit is mutatja, amelyek nagy értékváltozásokat fejezhetnek ki, amelyek sok nagyságrenddel nagyobbak.
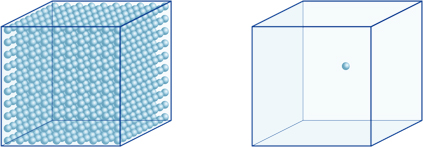
a bal oldali kockában lévő hidrogénionok száma (10-4mol/L) 1000-szer nagyobb, mint a jobb oldali kockában (10-7mol/L); ez egyenértékű a pH-érték 3 különbségével. (Egyetlen kék golyó 10-7mol/L hidrogénionokat jelent.)
Következő oldal hidrogén-Ion aktivitás
Leave a Reply