Concentratie van waterstofionen

vervolgens rijst de vraag wat de zuurgraad of alkaliniteit van een oplossing bepaalt.in feite wordt het bepaald door de concentratie van waterstofionen, het percentage waterstofionen in de oplossing.
laten we water als voorbeeld nemen.zoals u weet is de formule voor water H2O. de meeste moleculen in water zijn in die extreem stabiele vorm die we kennen als H2O.een zeer klein percentage van deze moleculen is echter opgesplitst in waterstofionen (H+) en hydroxideionen (OH -), zoals in de figuur wordt geïllustreerd.deze balans van waterstofionen en hydroxideionen bepaalt de pH van het water.
wanneer de waterstofionen groter zijn dan de hydroxideionen, is de oplossing zuur. Als het omgekeerde waar is, dan is de oplossing alkalisch.
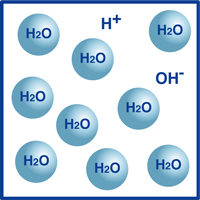
als de temperatuur niet varieert, wordt de volgende relatie tussen de dichtheid van waterstofionen (H+) en hydroxide-ionen (OH -) gevonden bij elke oplossing:
=Kw=10-14 (=vast) bij 25℃
(Kw wordt het ionproduct van water of dissociatieconstante van water genoemd.)
in zuiver water of neutrale oplossing geldt de volgende formule, omdat
=,
==√(Kw)=√10-14=10-7
Als u de waarde van een of kent , kunt u de waarde van de andere vinden.
dus meten we alleen en gebruiken het als de standaard voor pH. op deze manier wordt de pH bepaald door de waterstof-ionenconcentratie.

So, pH wordt gedefinieerd door de volgende formule:
pH=-log10
de concentratie van waterstofionen in elke oplossing die we waarschijnlijk tegenkomen zal variëren van 1 mol tot 0,000001 mol per liter oplossing. Oplossingen met een extreem lage concentratie waterstof-ionen kunnen echter een vrij lange parade van nullen achter de komma oprapen. De Deense biochemicus S. P. L. Sorensen was de eerste die het pH-systeem gebruikte dat we vandaag kennen, dat inverse getallen van waterstof-ionenconcentratie definieert die in gemeenschappelijke logaritme als pH worden getoond. Dat wil zeggen,
pH= – log10
in het geval van een neutrale oplossing,
=10-7, wat we een pH van 7 noemen.
Dit betekent bijvoorbeeld dat een waterstof-ionenconcentratie van een oplossing met een pH van 4 10-4mol/l is, wat betekent dat het 0,0001 mol waterstofionen bevat in een oplossing van 1 liter. Op dezelfde manier bevat een oplossing met een pH van 5 10-5mol/l waterstofionen, een oplossing met een pH van 6 10-6mol/l waterstofionen, terwijl de oplossing met een pH van 7 10-7mol/l waterstofionen bevat. Je zult merken dat als je oplossingen vergelijkt met pH van 4 en pH van 7, het verschil in pH is slechts 3, maar de concentratie van waterstofionen met een pH van 7 is 1000 keer zo hoog als met een pH van 4.De volgende figuur toont ook het voordeel van exponenten, die grote variaties in waarde kunnen uitdrukken die over vele ordes van grootte variëren.
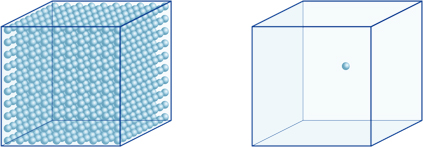
het aantal waterstofionen in de kubus links (10-4mol/L) is 1.000 keer groter dan in de kubus rechts (10-7mol/L); Dit komt overeen met een verschil van 3 in de pH-waarde. (Een enkele blauwe bal vertegenwoordigt 10-7mol / L waterstofionen.)
volgende pagina waterstof-Ion-activiteit
Leave a Reply