Koncentration av vätejoner

Nästa uppstår frågan om vad som bestämmer surheten eller alkaliniteten hos en lösning.
det bestäms faktiskt av koncentrationen av vätejoner, procentandelen vätejoner som ingår i lösningen.
låt oss ta vatten som ett exempel.
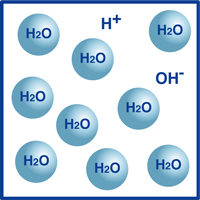
som du vet är formeln för vatten H2O. de flesta molekylerna i vatten är i den extremt stabila formen vi känner som H2O.
en mycket liten andel av dessa molekyler har emellertid brutits upp i vätejoner (H+) och hydroxidjoner (OH -), som illustreras i figuren.
faktum är att denna balans mellan vätejoner och hydroxidjoner bestämmer vattnets pH.
När vätejonerna överstiger hydroxidjonerna är lösningen sur. Om motsatsen är sant är lösningen alkalisk.
om temperaturen inte varierar, hittas följande förhållande mellan densiteterna av vätejoner (H+) och hydroxidjoner (OH-) med vilken lösning som helst:
=Kw=10-14(=fast) vid 25 kg
(Kw kallas jonprodukten av vatten eller dissociationskonstant av vatten.)
i rent vatten eller neutral lösning gäller följande formel, eftersom
=,
==kg(Kw)=10-14=10-7
om du känner till värdet på endera eller kan du hitta värdet på den andra.
således mäter vi bara och använder den som standard för pH. på detta sätt bestäms pH av vätejonkoncentration.

så definieras pH med följande formel:
pH=-log10
koncentrationen av vätejoner i vilken lösning vi sannolikt kommer att stöta på kommer att sträcka sig från 1 mol till 0,000001 mol per liter lösning. Lösningar med extremt låg vätejonkoncentration kan dock tänkas ställa upp en ganska lång parad nollor efter decimalpunkten. Den danska biokemisten S. P. L. Sorensen var den första som använde det pH-system vi känner idag, vilket definierar inversa antal vätejonkoncentration som visas i vanlig logaritm som pH. Det vill säga
pH= – log10
i fallet med en neutral lösning,
=10-7 , som vi kallar ett pH på 7.
detta innebär till exempel att en vätejonkoncentration av en lösning med ett pH av 4 är 10-4mol/l, vilket betyder att den innehåller 0,0001 mol vätejoner i en lösning av 1 liter. På samma sätt innehåller en lösning med ett pH av 5 10-5mol/l vätejoner, en lösning med ett pH av 6 innehåller 10-6mol/l vätejoner, medan lösningen med ett pH av 7 innehåller 10-7mol/l vätejoner. Du kommer att märka att om du jämför lösningar med pH på 4 och pH på 7 är skillnaden i pH bara 3, men koncentrationen av vätejoner med ett pH på 7 är 1000 gånger så högt som med ett pH på 4.Följande figur visar också fördelen med exponenter, som kan uttrycka stora variationer i värde som sträcker sig över många storleksordningar.
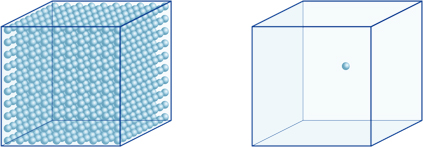
antalet vätejoner i kuben till vänster (10-4mol/L) är 1000 gånger större än i den till höger (10-7mol/L); Detta motsvarar en skillnad på 3 i pH-värdet. (En enda blå boll representerar 10-7mol/L vätejoner.)
Nästa sida Vätejonaktivitet
Leave a Reply