Concentrația ionilor de hidrogen

în continuare apare întrebarea a ceea ce determină aciditatea sau alcalinitatea unei soluții.
De fapt, este determinată de concentrația ionilor de hidrogen, procentul de ioni de hidrogen conținute în soluție.
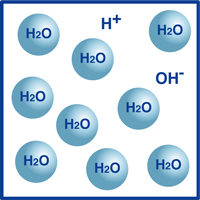
să luăm apa ca exemplu.după cum știți, formula pentru apă este H2O. majoritatea moleculelor din apă sunt în acea formă extrem de stabilă pe care o cunoaștem ca H2O.cu toate acestea, un procent foarte mic din aceste molecule s-au rupt în ioni de hidrogen (H+) și ioni de hidroxid, (OH -), așa cum este ilustrat în figură.
De fapt, acest echilibru de ioni de hidrogen și ioni de hidroxid determină pH-ul apei.
când ionii de hidrogen sunt mai numeroși decât ionii de hidroxid, soluția este acidă. Dacă inversul este adevărat, atunci soluția este alcalină.
Dacă temperatura nu variază, următoarea relație între densitățile ionilor de hidrogen (H+ ) și ionii de hidroxid (OH -) se găsește cu orice soluție:
=Kw=10-14(=fix) la 25%
(Kw se numește produsul ionic al apei sau constanta de disociere a apei.)
in apa pura sau in solutie neutra, urmatoarea formula este adevarata, deoarece
=,
==(Kw)=10-14=10-7)
daca cunoasteti valoarea oricarui sau , puteti gasi valoarea celuilalt.
astfel, măsurăm numai și îl folosim ca standard pentru pH. în acest fel, pH-ul este determinat de concentrația de ioni de hidrogen.

deci, pH-ul este definit de următoarea formulă:
pH=-log10
concentrația ionilor de hidrogen în orice soluție pe care este probabil să o întâlnim va varia de la 1 mol la 0,000001 mol pe litru de soluție. Cu toate acestea, soluțiile cu concentrație extrem de scăzută de ioni de hidrogen ar putea, probabil, să ridice o paradă destul de lungă de zerouri după punctul zecimal. Biochimistul danez S. P. L. Sorensen a fost primul care a folosit sistemul pH pe care îl cunoaștem astăzi, care definește numerele inverse ale concentrației de ioni de hidrogen prezentate în logaritmul comun ca pH. Cu alte cuvinte,
pH=-log10
în cazul unei soluții neutre,
=10-7 , pe care o numim un pH de 7.
aceasta înseamnă, de exemplu, că o concentrație de hidrogen-ion a unei soluții cu un pH de 4 este de 10-4mol / l, ceea ce înseamnă că conține 0,0001 mol de ioni de hidrogen într-o soluție de 1 litru. În același mod, o soluție cu un pH de 5 conține 10-5mol/l de ioni de hidrogen, o soluție cu un pH de 6 conține 10-6mol/l de ioni de hidrogen, în timp ce soluția cu un pH de 7 conține 10-7mol/l de ioni de hidrogen. Veți observa că dacă comparați soluțiile cu pH-ul 4 și pH-ul 7, diferența de pH este de numai 3, dar concentrația ionilor de hidrogen cu un pH de 7 este de 1000 de ori mai mare decât cu un pH de 4.Următoarea figură arată, de asemenea, avantajul exponenților, care pot exprima variații mari de valoare care variază pe mai multe ordine de mărime.
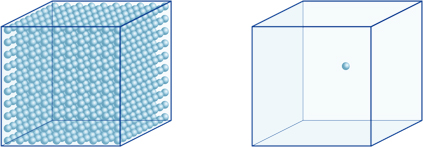
numărul de ioni de hidrogen din cubul din stânga (10-4mol/L) este de 1.000 de ori mai mare decât în cel din dreapta (10-7mol / L); Aceasta este echivalentă cu o diferență de 3 în valoarea pH-ului. (O singură bilă albastră reprezintă 10-7mol/l de ioni de hidrogen.)
Pagina următoare activitatea ionilor de hidrogen
Leave a Reply