Koncentrace Vodíkových Iontů

Další vyvstává otázka, co určuje kyselost nebo zásaditost roztoku.
ve skutečnosti je určena koncentrací vodíkových iontů, procentuálním podílem vodíkových iontů obsažených v roztoku.
Vezměme si jako příklad vodu.
Jak víte, vzorec pro vodu je H2O. většina molekul ve vodě je v extrémně stabilní formě, kterou známe jako H2O.
nicméně velmi malé procento těchto molekul se rozpadlo na vodíkové ionty (H+) a hydroxidové ionty (OH -), jak je znázorněno na obrázku.
ve skutečnosti tato rovnováha vodíkových iontů a hydroxidových iontů určuje pH vody.
když vodíkové ionty převyšují hydroxidové ionty, roztok je kyselý. Pokud je opak pravdou, pak je roztok alkalický.
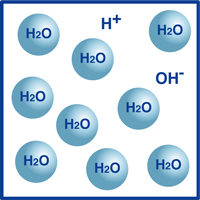
Pokud se teplota nemění, následující vztah mezi hustoty vodíkových iontů (H+) a hydroxidových iontů (OH-) je zjištěno, že se nějaké řešení:
=Kw=10-14 (=fixní) při 25℃
(Kw se nazývá iontový produkt vody nebo disociační konstanta vody.)
V čisté vodě nebo v neutrálním roztoku, tento vzorec platí, protože
= ,
==√(Kw)=√10-14=10-7
Pokud víte, hodnotu buď a nebo , můžete najít hodnotu ostatních.
Tak, měříme pouze a použít jej jako standard pro pH. Tímto způsobem, pH je určena vodíku-iontové koncentrace.

takže pH je definováno následujícím vzorcem:
pH=-log10
koncentrace vodíkových iontů v jakékoliv řešení, je pravděpodobné, že setkání se bude pohybovat v rozmezí od 1 mol na 0.000001 mol na litr roztoku. Řešení s extrémně nízkou koncentrací vodíkových iontů by však mohla za desetinnou čárkou představit docela dlouhou přehlídku nul. Dánský biochemik S. P. L. Sorensen byl první používat pH systém, jak ho známe dnes, který definuje inverzní čísla vodíku-iontové koncentrace uvedeny v dekadický logaritmus jako pH. To znamená
pH= – log10
v případě neutrálního roztoku
= 10-7, kterému říkáme pH 7.
To znamená, například, že vodík-iontová koncentrace roztoku s pH 4 je 10-4mol/l, což znamená, že obsahuje 0.0001 mol vodíkových iontů v roztoku 1 litr. Stejným způsobem, roztok s pH 5, obsahuje 10-5mol/l vodíkových iontů, roztok s pH 6 obsahuje 10-6mol/l vodíkových iontů, zatímco roztok s pH 7 obsahuje 10-7mol/l vodíkových iontů. Všimnete si, že pokud porovnáte roztoky s pH 4 a pH 7, rozdíl v pH je pouze 3,ale koncentrace vodíkových iontů s pH 7 je 1000krát vyšší než u pH 4.Následující obrázek také ukazuje výhodu exponentů,které mohou vyjadřovat velké rozdíly v hodnotě, které se pohybují v mnoha řádech.
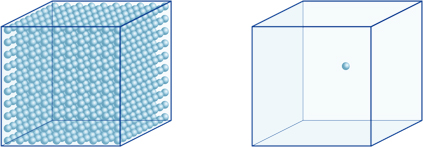
počet vodíkových iontů v krychli vlevo (10-4mol/L) je 1000 krát větší než ten na pravé straně (10-7mol/L); to je stejné, rozdíl 3 v hodnotě pH. (Jedna modrá koule představuje 10-7mol / L vodíkových iontů.)
Další stránka aktivita vodíkových iontů
Leave a Reply