水素イオンの濃度

次に、溶液の酸性度またはアルカリ度を決定するものの問題が発生します。
実際には、水素イオンの濃度、溶液中に含まれる水素イオンの割合によって決定されます。
水を例にしてみましょう。
ご存知のように、水の式はH2O.most水の中の分子は、我々はH2Oとして知っているその非常に安定した形である。しかし、図に示すように、これらの分子の非常に小さな割合は、水素イオン(H+)と水酸化物イオン(OH-)に分割されています。
実際には、この水素イオンと水酸化物イオンのバランスが水のpHを決定します。
水素イオンが水酸化物イオンを上回る場合、溶液は酸性である。 逆が真であれば、溶液はアルカリ性である。
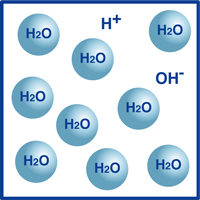
温度が変化しない場合、水素イオン(H+)と水酸化物イオン(OH-)の密度との間に以下の関係が任意の溶液で見出される:
=Kw=10-14(=固定)25℃で
(Kwは水のイオン積または水の解離定数と呼ばれます。純水または中性溶液では、次の式が成り立つため、
=、
==λ(Kw)=λ10-14=10-7
いずれかの値がわかっている場合または、他の値を見つけることができます。このようにして、pHは水素イオン濃度によって決定されます。
したがって、我々はpHの基準としてのみ測定し、それを使用します。

だから、pHは次の式で定義されます:私たちが遭遇する可能性のある任意の溶液中の水素イオンの濃度は、溶液1リットル当たり1molから0.000001molの範囲である。
pH=-log10
水素イオンの濃度は、溶液1リットル当たり1molから0.000001molの範囲である。 しかし、水素イオン濃度が極めて低い溶液は、小数点以下のゼロのかなり長いパレードを棚上げする可能性があります。 デンマークの生化学者S.P.L.Sorensenは、私たちが今日知っているpHシステムを最初に使用しました。phは、常用対数で示される水素イオン濃度の逆数をpHと定義しています。 すなわち、中性溶液の場合、
=10-7であり、これをpH7と呼ぶ。
これは、例えば、pHが4の溶液の水素イオン濃度が10-4mol/lであることを意味し、0.0001molの水素イオンを1リットルの溶液に含むことを意味する。 同様に、pH5の溶液には10-5mol/lの水素イオンが含まれ、pH6の溶液には10-6mol/lの水素イオンが含まれ、pH7の溶液には10-7mol/lの水素イオンが含 溶液をpH4とpH7と比較すると、pHの差はわずか3ですが、pH7の水素イオンの濃度はpH4の1000倍高いことに気付くでしょう。次の図はまた、指数の利点を示しています,これは、大きさの多くの桁にわたって範囲の値の大きな変化を表現することができます.
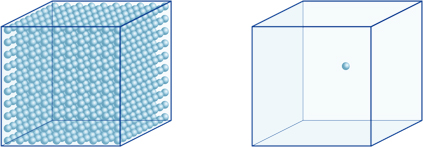
左の立方体(10-4mol/L)の水素イオンの数は、右の立方体(10-7mol/L)の1,000倍であり、これはpH値の3の差に相当します。 (単一の青い球は水素イオンの10-7mol/Lを表します。)
次のページ水素イオン活性
Leave a Reply