Natriumchloride eigenschappen / / is natriumchloride goed voor u?
Artikelonderwerpen
natriumchloride is een ionische verbinding met de chemische formule NaCl. Het is een kleurloos kubisch kristal of fijn kristallijn poeder en smaakt zout.
het uiterlijk is een wit kristal en de bron is voornamelijk zeewater, dat het hoofdbestanddeel is van keukenzout. Oplosbaar in water, glycerine, lichtjes oplosbaar in ethanol (alcohol), vloeibare ammoniak, onoplosbaar in geconcentreerd zoutzuur. Onzuivere natriumchloride is deliquescent in de lucht.
de stabiliteit is relatief goed en de waterige oplossing is neutraal. Industrieel, wordt de methode van elektrolytisch verzadigde natriumchlorideoplossing over het algemeen gebruikt om waterstof, chloor en bijtende soda (natriumhydroxide) en andere chemische producten (algemeen genoemd chloor-alkali-industrie) te produceren.
Het kan worden gebruikt bij oresmelting (elektrolytisch smelten van natriumchloridekristallen om activemetaalnatrium te produceren), medisch gebruikt om fysiologische zoutoplossing te configureren, en het dagelijkse leven kan worden gebruikt voor specerijen.
Samengestelde Inleiding
Basic Informatie
naam om het engels: sodium chloride
engels alias: natrium-hydrochloride; Sodiumchloride
CAS: 7647-14-5
Moleculaire formule: NaCl
Moleculair gewicht: 58.44280
de Exacte massa: 57.95860
Informatie Beveiliging
de Douane code: 2501002000
het Gevaar van categorie code: R36; R22
veiligheidsinstructies: S24 / 25-S26
Gevaarlijke goederen teken: Xi
Fysische eigenschappen van Natrium chloride
Weergave en eigenschappen: kleurloze kristallen orwhite poeder
Dichtheid: 2.165g/cm3 (25 ° c)
Oplosbaarheid in Water: 360 g/L (25 ºC)
stabiliteit: Stabiel onder normale verzend-en behandelingsomstandigheden.
Opslagcondities: lage temperatuur, geventileerd en droog in magazijn
Dampdruk: 1 mm Hg (865 ° C)
smeltpunt: 801 ° c
kookpunt: 1465 Sodium
natriumchloride is een wit reukloos kristallijn poeder. Mp 801 graden.] C, een kookpunt van 1465 graden.] C, lichtjes oplosbaar in ethanol, propanol, butaan, butaan, en nadat het plasma mengbaar wordt, oplosbaar in water, de oplosbaarheid in water van 35,9 g (kamertemperatuur).
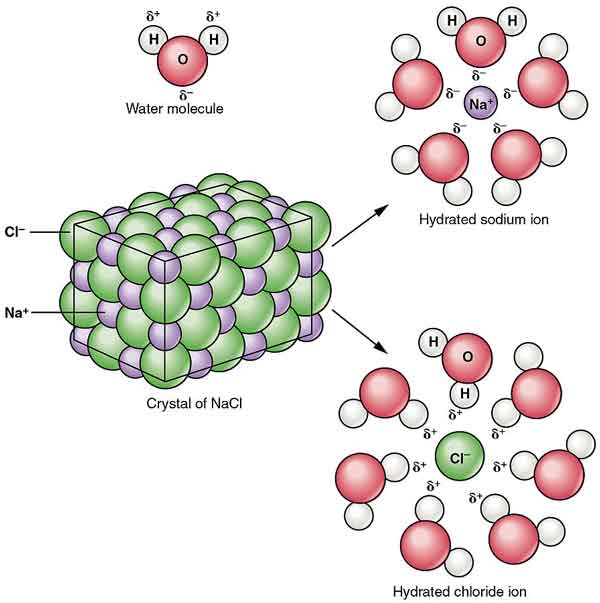
NaCl wordt gedispergeerd in alcohol om colloïden te vormen. De oplosbaarheid in water wordt verminderd door de aanwezigheid van waterstofchloride, en het is bijna onoplosbaar in geconcentreerd zoutzuur.
chemische eigenschappen van natriumchloride
de kristallen van natriumchloride vormen stereo-symmetrie. In zijn kristalstructuur vormen de grotere chloride-ionen de dichtste verpakking in de kubus, en de kleinere natriumionen vullen de octahedrale kloof tussen de chloride-ionen. Each ion is surrounded by six other ions. This structure is also found in many other compounds, called sodium chloride type structure or stone salt structure.

1. Preparationof sodium metal by electrolytic melting of sodium chloride
2NaCl(molten) = 2Na + Cl2
2. Electrolytic saltwater
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
3. React withsilver nitrate
NaCl + AgNO3 = NaNO3 + AgCl
Ionic equation:
Cl– + Ag+ = AgCl
(Which is theessence CI – property)
4. Reaction withconcentrated sulfuric acid (laboratory hydrogen chloride)
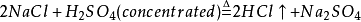

( Concentrated behalfconcentrated, Excess Representative excess)
5.NaCl test
A: chloride werd druppelsgewijs toegevoegd aan een oplossing van salpeterzuur had aangezuurde oplossing van zilvernitraat, een witte neerslag (neergeslagen zilverchloride) wordt gegenereerd, bewezen CI– .
B: dompel een kleine hoeveelheid oplossing met platinadraad en zet deze op een alcohollamp om te branden. De vlam is geel en het kan worden bewezen dat het Na+bevat.
C: om interferentie te voorkomen, kan de oorspronkelijke testoplossing met verzadigd bariumhydroxide worden toegevoegd tot deze duidelijk alkalisch is. Op dit moment zullen de meeste kationen en anionen zoals PO43− en AsO43− neergeslagen worden.
Ba2 + die in de testoplossing wordt ingebracht, moet met ammoniumcarbonaat worden verwijderd en ten slotte moet ammoniumzout door verbranding worden verwijderd. Nadat het residu met water was uitgelogen, werd de oplossing aangezuurd met HAc, en het uranylzinkacetaatreagens werd toegevoegd volgens het aantal druppels van 1: 8, en de buiswand werd ingewreven met een glazen staaf. Als Citroengele kristallen werden gevormd, was Na+ aanwezig.
preparaat van natriumchloride
industriële methode
in zoutvelden gebracht door zeewater (gemiddeld 2.4% natriumchloride) en gedroogd in de zon, geconcentreerd om te kristalliseren om een ruw product te verkrijgen. Het zeewater kan ook worden verhit met stoom, gefilterd met een zandfilter en geconcentreerd door ionenwisselmembraanelektrodialyse om pekel te verkrijgen (met natriumchloride 160-180g / L).
het halogips wordt door verdamping neergeslagen en het verkregen chlorine wordt gecentrifugeerd. Meer dan 95% natrium (2% vocht) kan worden gedroogd om gemeenschappelijk zout te verkrijgen. Steenzout en zoutmeer pekel kan ook worden gebruikt als grondstoffen en gedroogd in de zon om rauw zout te verkrijgen.
wanneer ondergrondse pekel en putzout als grondstof worden gebruikt, worden deze geconcentreerd door verdamping met drie of vier effecten,worden kristallen neergeslagen en gecentrifugeerd om te verkrijgen.
laboratoriummethode
het ruwe zout wordt opgelost in water om onoplosbare onzuiverheden te verwijderen, en geraffineerde preparaten zoals natriumhydroxide en natriumcarbonaat worden toegevoegd om oplosbare onzuiverheden zoals SO42-, Ca2+ en Mg2+ tot precipitaten te maken, te verwijderen gefilterd en uiteindelijk gezuiverd met de pH werd ingesteld op 7 met zoutzuur, en de oplossing werd geconcentreerd om zuivere natriumchloridekristallen te verkrijgen.
de bereidingsmethode in het laboratorium bestaat erin een gelijke hoeveelheid zoutzuur met natriumhydroxide te mengen tot een natriumchlorideoplossing. De oplossing werd vervolgens bewerkt om natriumchloridekristallen te verkrijgen. De belangrijkste reactie:
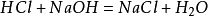
bovendien zal natriumchloride ook natriumchloride produceren wanneer het in de omgeving van chloorgas wordt ontstoken. De chemische vergelijking is:
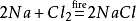
Wat is natriumchloride gebruikt voor
industrie
1. Wanneer elektrolytische natriumchloride-oplossing iselektrolyzed, waterstof en chloorgas zal worden gegenereerd. Chloorgas heeft een breed scala aan toepassingen in de chemische industrie en kan worden gebruikt om polyvinylchloride, pesticiden, zoutzuur, enz.te synthetiseren.
2. Bereiding van natriummetaal volgens de Dangs-methode: bereiding van natriummetaal door elektrolytisch smelten van een mengsel van sodiumchloride en calciumchloride. Calciumchloride wordt gebruikt als een flux om het smeltpunt van natriumchloride te verlagen tot onder 700 ° C. Calcium is minderreductief dan natrium en introduceert geen onzuiverheden.
3. Natriumchloride is nodig voor veel biologische handelingen. Bijvoorbeeld, bevatten diverse oplossingsformules in moleculaire biologische experimenten natriumchloride, en het grootste deel van het bacteriekweekmedium bevat natriumchloride. Het is ook de grondstof bij de productie van sodaas door de ammoniak-alkali-methode.
4. Anorganische en organische industrieën worden gebruikt als grondstoffen voor de productie van bijtende soda, chloraat, hypochloriet, bleken poeder, koelmiddelen voor koelsystemen, grondstoffen voor organische synthese en zouten-out agenten. De staalindustrie wordt gebruikt als warmtebehandelingsmiddel. Een hittebron op hoge temperatuur wordt gebruikt om een zoutbad te vormen met kaliumchloride, bariumchloride, enz., die kan worden gebruikt als verwarmingsmedium om de temperatuur tussen 820-960 ° C. Bovendien wordt het ook gebruikt in glas, kleurstoffen, metallurgie en andere industrieën.
5. Analytische reagentia worden gebruikt als fluor-en silicatetrace-analysereagentia.
6. Natriumasproductie volgens de alkalimethode van Hou: de tweede stap: de in de eerste stap bereide ammoniumbicarbonaatoplossing wordt gemengd met de natriumchlorideoplossing om natriumbicarbonaat en dammoniumchloride bij 10°C te verkrijgen.
Voedingsmiddelenindustrie
de voedingsmiddelenindustrie en de visserij worden gebruikt voor het zouten, evenals grondstoffen voor kruiderijen en geraffineerd keukenzout.
het toevoegen van zout aan kookgerei kan sommige geuren van grondstoffen verwijderen en de smaak verhogen, wat het effect is van zoutvrees. “Licht smaakloos, zout en smaakloos” betekent datde juiste hoeveelheid zout kan worden gebruikt om zijn unieke functies uit te oefenen.
Medisch
natriumchloride is zeer belangrijk voor het leven op aarde. De meeste biologische weefsels bevatten meerdere zouten. De concentratie van natrium in het bloed houdt rechtstreeks verband met de regulering van het veilige niveau van lichaamsvloeistoffen. De geleiding van zenuwimpulsen veroorzaakt doorsignale conversie wordt ook geregeld door natriumionen.
Water met 0,9% natriumchloride wordt Saline genoemd omdat het dezelfde osmotische druk heeft als plasma. Normale zoutoplossing is de belangrijkste lichaamsvochtvervanger. Het wordt veel gebruikt bij de behandeling en preventie van uitdroging, en het wordt ook gebruikt bij de behandeling van intraveneuze injectie en de preventie van hypovolemische shock.
In tegenstelling tot andere primaten scheiden mensen door zweten grote hoeveelheden natriumchloride af.
natriumchloride is onmisbaar voor mensen. De totale hoeveelheid natriumionen in volwassenen is ongeveer 60 g, waarvan 80% in extracellulaire vloeistof, dat wil zeggen in plasma en intercellularfluid. Chloride is ook voornamelijk aanwezig in extracellulaire vloeistof. De fysiologische functies van natrium-en chloride-ionen zijn:
(1) het handhaven van de osmotische druk van de extracellulaire vloeistof.
(2) Neem deel aan de regulering van de zuur-base balans in het lichaam.
(3) Chloride is betrokken bij de productie van gastroenzuur in het lichaam. Daarnaast speelt natriumchloride ook een rol bij het behoud van de normale prikkelbaarheid van zenuwen en spieren.
landbouw
zijn waterige oplossing kan worden gebruikt voor zaadselectie. De NaCl-oplossing is geconfigureerd volgens de behoeften van despecies, en de dichtheid is groter dan die van water. Zaden worden gezet intoNaCl oplossing, drijven vol en zinken vol.
andere
volgens nieuwe bevindingen van het SingaporeScience and Technology Research Institute kan natriumchloride de capaciteit van harde schijven aanzienlijk verhogen. Specifiek, maakt de bestaande conventionele harde schijf gebruik van een willekeurig toegewezen magnetische schijfopslagtechnologie, die slechts een gegevensdichtheid van 0,5 TB per vierkante inch kan bereiken.
de nieuwe technologie profiteert van de hulp van sodiumchloride. Met de nieuwe high-resolution lithografiefactortechnologie, zal de datadensiteit meer ordelijk zijn en 3 bereiken.3TB per vierkante inch zonder de needfor ingewikkelde apparatuur upgrades. Met behulp van 1TB harde schijf met thistechnologie kan 6TB capaciteit bereiken zonder schijven toe te voegen.
- Ammoniak Formule || waarom ammoniak is giftig || Ammoniak Vergiftiging
- Waarom Ozonlaag is Belangrijk || Aantasting van de Ozonlaag
- Wat is de Concentratie van de oplossing || Hoe de Concentratie van Invloed Reactie
- Waarom Koolstof Cyclus is Belangrijk, | | Hoe het Werkt
- Haloalkanes en Haloarenes NCERT Oplossingen || Haloalkane Structuur
- Kooldioxide Cyclus en Formule || Hoe Kooldioxide wordt Geproduceerd
Leave a Reply